

腸は、人間の生命維持にとって、きわめて重要な役割を果たしている。
その役割は、栄養分の消化・吸収にとどまらない。腸の表面の粘膜層には体内の免疫細胞の約6割が存在し、免疫機能において腸が決定的な働きをしていることが分かってきたのだ。
東京大学医科学研究所の清野宏教授は、腸の「粘膜免疫システム」をテーマに、幅広く研究に取り組んでいる。免疫システムの仕組みの解明に向けた研究を通して「粘膜免疫学」の創生に貢献するとともに、疾病予防や創薬のための応用研究にも力を注ぐ。教授いわく、「粘膜免疫システムは、次々と新発見がなされる“宝の山”」だ。
未知なる世界に挑む研究の最前線を、清野教授に伺った。
人間は、ものを食べなければ生きてはいけない。口に入れた食べものは、口腔内の唾液と胃腸の働きで消化され、主に栄養分は小腸で、水分は大腸で吸収される。
消化・吸収器官である小腸は、長さがおよそ6メートルにもなり、表面には「絨毛(じゅうもう)」と呼ばれる小さな突起が密集している。それは、凹凸によって表面積を増やし、養分吸収を効率的にするためだ。小腸表面を広げるとテニスコート半面以上分にもなり、皮膚の面積の100倍以上にもなると推定される。
そこには、数千億から1兆個もの免疫細胞が存在している。これは、体内に存在する免疫細胞の約6割にものぼる数だ。小腸は、消化・吸収の役割を担うだけでなく、最大の免疫臓器でもあったのだ。
なぜ、消化・吸収を担う小腸で、これほどまでに免疫機構が発達したのか――。その理由を、清野教授は次のように語る。
「人の体を口の中から眺めると、喉から食道、胃腸を経て肛門に至るまで、ホースのような筒状の構造をしています。人は、食べたものをこれらの消化管から体内に取り込みますが、食べものと一緒に細菌やウイルスなどの病原体が紛れ込んできます。つまり、消化管は病原体と接する境界で、そこには病原体の侵入を阻むための仕組みが必要です。特に小腸は、栄養分を体内に吸収する働きをしますから、腸は人体にとって有益なものと有害なものを見分ける重要な役割を担っているため、そこに免疫機構が発達したと考えられています」
胃腸のことを指して「おなか」とよく言うが、人体の物理構造を見るとこの表現は正しくない。通常「中」だと思われている消化管は筒の「穴」、つまり物理的に見ると人体の「外部」だ。そのため、消化管は「内なる外」とも表現される。人体が「外部」と接する境界面に、異物の侵入を阻む免疫システムが発達してきたのだ。
そして、消化管の表面は粘膜で覆われている。臓器の細胞を直接「外部」にさらさないようにするための防御膜だ。そこで、人体に有害なものを排除し、有益なものだけを選択して体内に取り入れる。清野教授は、この「腸管粘膜免疫システム」と呼ぶメカニズムの解明に取り組んでいる。

実験に取り組む学生たちと談笑する清野教授。研究室には、心地よい緊張感のなかにも和やかな雰囲気があった。
免疫には、多くの動物が先天的に有する「自然免疫」と、脊椎動物に固有の「獲得免疫」という2つの段階がある。「自然免疫」は、体内に侵入してきた異物を誰彼かまわず認識し、ときには捕食し、そして免疫系の活性化を促す。これに対し「獲得免疫」は、侵入してきた異物の違いを見きわめ、より高度な方法で異物ごとに撃退を試みる。
「獲得免疫」は、高度な仕組みで病原体への高い特異性と抵抗性を示す反面、仕組みが複雑な分、迎撃体制を築くのに時間がかかり、それまでのつなぎ役を「自然免疫」が担っている。また、近年の研究により、「自然免疫」には「獲得免疫」を司る細胞群を活性化する役割があることも明らかにされている。
「獲得免疫」の最大の特徴は、侵入した異物を記憶することにある。そのため、同じ異物が2度目に侵入してきた際は、速やかに迎え撃つための「記憶免疫誘導」にも貢献している。一度感染した病原体に対して抵抗力を「獲得」するため、この名がつけられた。
「この仕組みを活用したのがワクチンです。病原体の毒性を弱め、あるいは働きを抑えたものを投与して、獲得免疫を司る免疫細胞を誘導・活性化させる。それにより、病原体の侵入に対して速やかに迎撃体制をとることができ、感染に対する予防体制が構築されます。そのためワクチンは“予防注射”とも言われます。ワクチンは、免疫細胞に病原体に代表される有害な異物を覚えさせることで、2度目以降の侵入に素早く対応することができるのです」(清野教授)

腸管粘膜免疫について語る清野教授。力強い眼差しから、研究への熱い思いが感じられた
ほとんどの「ワクチン」は注射によって投与されるが、清野研究室では、口から投与する「経口ワクチン」の開発に取り組んでいる。口から消化管を通り、腸管の粘膜免疫システムを活性化するのが狙いだ。
人の免疫システムは、どこで免疫細胞が作用するかで大きく2つに分けることができる。全身に張り巡らされたリンパ節や脾臓などの組織で働く全身免疫と、腸管をはじめとして粘膜で作用する粘膜免疫だ。注射型ワクチンは主に前者の全身免疫系を介して、経口ワクチンは主に後者の粘膜免疫系を介して、病原体に特異的な免疫を活性化する。経口ワクチンの利点はその先にある。粘膜免疫が活性化されるだけでなく、全身の免疫も誘導されるのだ。一方で、注射型ワクチンは全身免疫を活性化するが、粘膜免疫を活性化することができない。
「消化管の粘膜は、多くの病原体と接する“内と外との境界面”です。粘膜免疫を誘導すると、入り口で病原体をシャットアウトするだけでなく、体内の臨戦態勢も整えることができます。対する注射型ワクチンは、入り口の粘膜面は無防備なまま、体内の臨戦態勢だけを整えています。例えて言うなら、経口ワクチンは家の玄関や窓にカギをかけ、室内に警備員も配備した状態ですが、注射型ワクチンは、家にカギをかけずに室内に警備員を待機させるようなものです。注射型ワクチンでは、病原体の侵入そのものを防ぎきることはできません」
たとえば、インフルエンザのワクチンを打っても、感染によって微熱が出ることがあるのはこのためだ。全身免疫は誘導されているため、病原体を速やかに撃退し、重症化するのは防ぐことができる。だが、粘膜面での免疫が誘導されておらず、鼻や喉の粘膜からインフルエンザウイルスの侵入を許してしまうのだ。
腸管の粘膜免疫を誘導すれば、病原体の侵入そのものを防ぐことができる。であるならば、すべてのワクチンが経口投与になって然るべきはずだ。それなのに、なぜほとんどのワクチンは注射による投与のままなのか――。
それには、経口ワクチン特有の難しさがある。腸管粘膜にまでワクチン抗原を届けるには、消化器官をくぐり抜けなければならないのだ(抗原とは、免疫細胞が認識する異物のこと)。清野研究室では、コメを遺伝子改変してワクチン抗原を組み込み、腸管粘膜までの確実な送達を目指して開発研究に取り組んでいる。
イネの種子であるコメは、自身が成長するのに必要なタンパク質をつくり、蓄えておくことができる。その場所は「タンパク貯蔵体」と呼ばれ、球状のカプセルのような形をしている。清野教授らは、コメにワクチン抗原となるタンパク質をつくらせ、タンパク貯蔵体に蓄えられるコメの開発に成功した。貯蔵体が自然型カプセルとしてワクチン抗原を内包することで、消化による分解を回避して、腸管粘膜まで確実にワクチンを送達することができるようになったのだ。
清野教授が、開発の難しい経口ワクチンにこだわるのには大きな理由がある。研究室では、コレラのワクチン抗原を組み込んだコメの開発に取り組んでいる。コレラは、重篤な下痢症状を引き起こし、死にも至る感染症だ。主に開発途上国で広まっている。開発途上国の経済状況や医療環境を考慮すると、注射型ワクチンよりも経口ワクチンの方が圧倒的に適している。
「社会インフラが不完全な開発途上国では、医療機関に冷蔵設備が十分に備わっているとは言えません。ワクチンを広く届け、多くの人に投与するには、冷蔵せずに長期保存が可能でなければなりません。常温で長期保存が効くものと言えば穀物です。なかでもコメは、植物学や農学分野でさまざまな研究の蓄積があります。また、人口の多い開発途上国で注射器・注射針を使うと、大量の医療廃棄物の処分が新たな問題になりますが、経口ワクチンならそのような廃棄物が出ません。また、貧しい開発途上国では、注射器・注射針を使い回すことによる二次感染も懸念されますが、この問題も、経口ワクチンなら回避することができます」
すでに、マウスやブタ、サルでコメ型経口ワクチンの効果が確認済みだ。さらに、ヒトへの応用を目指し、医科学研究所の附属病院において、同ワクチンの安全性を検討するヒトでの第一相臨床治験が実施され、その安全性も確認されいる。今は、ワクチンの有効性を検討するため、流行地での臨床治験の準備段階が進んでいるところだ。
このコメ型ワクチンの名は「ムコライス(MucoRice)」という。「粘膜」を意味する「Mucosal」と「Rice(コメ)」を掛け合わせたネーミングだ。
「ムコライスは、あくまで医療用ワクチンとして開発していて、食料として流通させることはまったく考えていません。遺伝子改変種が野生種や栽培種と交雑するのを防ぐとともに、医薬品としての製造基準を満たすため、屋内の完全閉鎖空間で栽培しています。出荷するときにはコメを粉末にして、それをワクチンの原薬とします。そのための設備開発も進め、同施設を本学医科学研究所内に整備し、屋内での安定かつ効率的な栽培技術とあわせて研究開発に取り組んでいます」
粘膜免疫システムのメカニズムを解明する基礎研究から、創薬や栽培技術につながる応用研究まで――。両者を同時並行で進めるのが清野教授のこだわりだ。

研究所内に設けられた「ムコライス(MucoRice)」の栽培設備。
(左)植物は、光に含まれる主に赤と青の波長を受け取り光合成を行う(緑の光は光合成にはあまり利用されない)。部屋の光が緑なのは、植物に「夜」を感じさせるため。「昼」の時間には白色光が灯される。
(右)「ムコライス」の前で。開発者の誇らしさが感じられる。

マウスを使った実験も、研究の重要なプロセスだ。
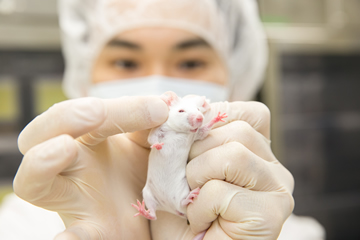
遺伝子改変したマウスは、徹底した個体管理が求められる。マウスの耳に穴を開け、その数で個体を管理する。

マウス室内で、実験に励む学生たちと。教授自身は「久しぶりにマウス室に来た」とのこと。
もともとは歯医者になろうと思っていた――。清野教授は学生時代をそう振り返る。
教授が6年制の歯学部を卒業したのは1977年のこと。そのころ歯学分野では、教授の人生を変える転機となった大きな発見がなされた。虫歯(う蝕)の原因菌のひとつが同定されたのだ。それを機に、ワクチンでの虫歯予防を目指すプロジェクトが米国を中心に動き始め、清野教授もそれに参加する機会を得た。そこで教授は、「粘膜免疫」の存在に気づき、その面白さに惹かれ、研究者としての道を歩み始めることになった。
「筒状の構造をした人体の“穴”は、人が生きるための飲食や排泄といった生理行為が行われる場所です。そして、“穴”の表面は粘膜で覆われています。それが生体防御のためなのだとすれば、そこに異物の侵入を監視するための監視機構があってもおかしくないはずです。次第に興味が口の中から下の方へ移り、腸管の免疫組織を研究するようになりました」
米国留学中の大学院では、腸管粘膜免疫システムのなかでも特に重要な役割を担う「パイエル板」について主に研究した。
「パイエル板」とは、小腸表面のところどころに見られる「絨毛」が未発達の場所だ。教授が学生だった当時から300年近く前の1677年、スイスの医師パイエル(Peyer)が発見し、見た目があたかも「あて布(patch)」を当てたかのようであったため、自身の名前をとって「パイエル板(Peyer’s patch)」と名付けた。
3世紀もの時が流れ、1970年代になってようやく、腸内に多くの免疫細胞が存在し、なかでも「パイエル板」に免疫細胞が密集していることが分かってきた。清野教授はまさに、時代の最先端の研究テーマと向き合い、「パイエル板」の細胞分布やそれらの細胞の働きを解き明かすことに励んだ。
清野教授が腸管粘膜免疫の研究に取り組んで40年近く、この分野は今も新たな発見が相次いでる。近年特にホットなのが、腸の粘膜層に生息する「腸内細菌」との相互作用だ。
腸の粘膜層には、数百種類、100兆個もの細菌が住み着き、腸管を構成する細胞と共生関係にあるとされる。腸管粘膜免疫システムが形成・発達・維持される際、腸内細菌が重要な役割を果たしていることも確認されている。すなわち、「腸内細菌が形成する生態系と、腸管の細胞群からなる生態系が常に相互作用をすることで、腸内粘膜免疫は正常に機能する」(清野教授)というわけだ。
腸の表面は、粘膜を介して常に「外界」と接する。その「外界」の環境は、人が飲み食いするものの影響を受け、どんな細菌が住み着くかも、それによって変わってくるはずだ。こうした腸内の多様な環境に対応するため、腸管粘膜免疫システムも柔軟に変化することが容易に想像される。
「今後も、この分野では新たな発見が相次ぐことでしょう。粘膜に関連する組織・臓器や、そこに生息する微生物の新しい遺伝子やタンパク質、未発見の細胞や微生物、微小組織が見つかる可能性だってあります。この分野は、未知なるものとの遭遇が約束された“宝の山”です。これまでの常識を覆す大発見もありえますし、画期的な薬剤や治療法を開発することだってできるかもしれません。若い人たちの果敢な挑戦を期待したいですね」
未来を担う学生たちへの期待を込め、清野教授は力強く語った。

まだ見ぬ世界に思いを馳せ、学生たちにエールを送る。
取材中、印象的だった清野教授の姿がある。研究室の学生だけでなく、スタッフや大学の職員の方々とすれ違うたび、にこやかに親しげに声をかける。その気配りが通じてか、研究室の雰囲気は和やかで、学生たちはのびのびと、自身の研究に取り組んでいるように見えた。
教授が学生やスタッフを思う心配りは、研究室の運営方針にもあらわれている。教授は、その名も「TMP FREEDOM」という運営方針を掲げる。「FREEDOM」が意味するのは、以下のそれぞれの英語の頭文字だ。
「TMP」は研究室の通称「Tokyo Mucosal Patches」の頭文字だ。「Mucosal」は「粘膜」を意味し、「Patches」は、粘膜免疫の研究分野にとって重要な「パイエル板(Peyer’s patch)」に由来する。
「パイエル板」を構成する細胞は、一つひとつが重要な役割を担い、免疫システム全体が機能する。それと同じく、研究室の学生もスタッフも、一人ひとりが重要な役割を担うことで、研究室全体で高いパフォーマンスを発揮する。
「FREEDOM」の精神にのっとり、各人が重要な役割を果たしつつ、とことん自由に(FREEDOM)研究に励む。その先に、粘膜免疫の新たな地平が拓けてくることを期待したい。

研究室のメンバーと毎年つくるTシャツを着て。胸に書かれているのは「Tokyo Mucosal Patches」の文字。本棚の上には、過去につくったTシャツが飾られている。
1977年、日本大学松戸歯学部歯学科卒業、1983年、米国アラバマ大学バーミングハム校メディカルセンター医学系大学院 博士課程修了。同メディカルセンターの研究・臨床助教授や独マックスプランク生物学研究所の上席研究員などを経て、1991年アラバマ大学バーミングハム校メディカルセンター教授に就任。1994年に日本に帰国し、大阪大学微生物病研究所教授、同研究所実験動物施設・施設長を経て、2003年に東京大学医科学研究所に教授として着任。同研究所感染・免疫部門・部門長や研究所副所長、所長を歴任。米国滞在中から一貫して、粘膜免疫学の学問体系確立と、その臨床応用を目指した研究に取り組む。

東京大学医科学研究所は、附属病院を持つ我が国最大規模の医科学・生命科学の研究拠点である。その歴史は、明治25(1892)年に北里柴三郎が創立した「私立衛生会附属伝染病研究所」に始まる。明治32(1899)年に内務省所管の国立伝染病研究所となり、大正5(1916)年には東京帝国大学(現・東京大学)附属の伝染病研究所になった。設立当初から病院を有し、「ベンチからベッドへ、ベットからベンチへ」の精神のもと、伝染病に苦しむ人々の治療に向けた研究と医療が進められた。20世紀半ばに我が国の衛生状況が改善されると、伝染病研究所は医科学研究所へと改組され、研究・治療の対象はがんや免疫疾患にも広がった。現在では、さまざまな難治疾患を対象にした最先端の研究と治療が進められている。
【取材・文:萱原正嗣/撮影:カケマコト】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png