

がんは日本人の死亡原因の1位であり、3人に1人ががんで亡くなっている。特に、遠隔臓器への転移や薬剤耐性を原因とする「がんの悪性化進展」を制御することは、がんの克服にとってきわめて重要な課題だ。
金沢大学がん進展制御研究所の松本邦夫教授は、がんの転移や薬剤耐性獲得を防ぐ化合物の作製に成功した。この化合物は、がんの治療薬や画像診断法の開発など、臨床への応用が期待されている。さらに、松本教授の一連の研究は、がん以外の難病治療の道も切り開こうとしている。
がん細胞は、なぜ増えるのか――。実は、がん細胞は、正常な細胞が生きていくのに必要な仕組みを巧妙に利用し、増殖している。
この、「正常な細胞が生きていくのに必要な仕組み」というのが、「細胞増殖因子」と呼ばれるタンパク質である。細胞が外部からこの増殖因子を受け取ると、細胞内部で細胞分裂のスイッチがオンになり、細胞は増殖する。細胞増殖因子は、さまざまな種類のものが見つかっていると松本教授は言う。
「神経細胞や表皮細胞、骨細胞や血管内皮細胞など、体内のさまざまな細胞ごとに、固有の細胞増殖因子があります。私はこうした増殖因子のなかで、肝細胞増殖因子(HepatocyteGrowthFactor:以下HGF)の研究を30年ほど続けています。名前のとおり、肝臓の細胞増殖を促すタンパク質ですが、HGFは皮膚や神経など、肝臓以外の細胞が傷ついたときの修復も促します。肝臓は再生力の高い臓器で、人体内で1.2 kgほどある肝臓が300~400 gぐらいになっても、1ヶ月ほどで元通りの大きさに戻ります。こうした肝臓の再生力の高さは、主にHGFの働きによるものです」
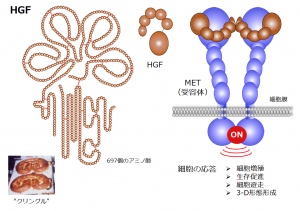
図1:HGFが細胞膜のMET受容体と結合すると、細胞の増殖や遊走、3次元形態形成、生存促進などのスイッチがオンになる。HGFは、697個のアミノ酸からなる高分子タンパク質だ。HGFは、北欧の菓子「クリングル」に似ている構造、「クリングル構造」を4個もっている。
HGFが、細胞表面のMETと呼ばれるレセプター(受容体)と結合すると、細胞内部で細胞増殖のスイッチがオンになる。だが、「HGFが促すのは細胞増殖だけではない」と松本教授。「細胞が動いたり(遊走)、臓器の形態を立体的に形成したり、損傷した細胞が生き延びたりすることも、HGFの作用を抜きには語れません」
たとえば、人の皮膚に傷ができた際、その傷が治るのにはHGFが必要だ。人の皮膚表皮細胞を培養して引っかき傷をつくった実験では、培地にHGFを加えた環境で、細胞が動いて傷が修復する様子を確認できた。「細胞が“動く”というのが重要で、それによって傷を修復しています」このときHGFは、細胞をダイナミックに動かす因子になっている。
また、臓器を立体的に形作るのにもHGFが必要となる。腎臓のなかで尿を運ぶ微小な管をつくる細胞を培養した実験では、HGFを加えた培地では、管が立体的につくられたが、HGF以外の細胞増殖因子では、細胞が増えはしたものの、立体的な管の形にはならなかった。「3次元での立体的な形態形成は、HGFに特徴的な働きです。HGFはただ細胞を増やすだけでなく、3次元でダイナミックに細胞を動かし、傷を修復したり、管状の組織を立体的につくったりする働きがあるのです」
さらに、細胞が死ぬのを防ぎ、生き延びさせる活性も、HGFに特徴的な働きだ。その典型的な例が、運動神経である。
運動神経は、筋肉とつながって筋肉を動かす重要な役割を担うが、一度死んでしまうとそれが再生することはない。例えば、脊髄が損傷された際に運動神経が死んでしまう。脊髄損傷によって体を動かせなくなるのはそのためだ。
ところが、「HGFがあると、脊髄を損傷しても運動神経が死なずに生き延びることができます」と松本教授は言う。サルを使って実験的に脊髄を損傷させた場合、HGFを投与すると、運動神経が死なずに生き延びて、運動機能を維持することが明らかにされている。
なお、HGFが運動神経を生き延びさせる働きを利用して、脊髄損傷に加え、運動神経が徐々に死滅する難病ALS(筋萎縮性即索硬化症)の治療薬の開発が進んでいる。これには、松本教授が2001年に創業したバイオベンチャーも大きく関わっているのだが、それについては後ほどあらためて紹介する。
このように、HGFは細胞が増殖し、さらには、細胞からなる組織が正常に機能するために欠かせないものだが、がん細胞は、この仕組みを巧みに利用する。
「がん細胞は、HGFが細胞の遊走や立体的な形態形成を促す働きを利用して、浸潤や転移を来たして悪性化します。また、がん細胞が細胞の生存を促すHGFの働きを利用すると、抗がん剤にさらされても生き延びてしまう、つまり耐性を獲得します。細胞や組織の正常な働きに必要なHGFが、がん細胞の悪性化を引き起こす要因になっているのです」

作製した化合物HiP-8の可能性について語る松本教授。HiP-8は、「大きな可能性を秘めている」という。
では、がん細胞の悪性化を促すHGFの働きを阻害することができれば、がん治療薬になるのではないか――。松本教授はその点に着目して研究に取り組み、東京大学の菅裕明教授らとともに、HGFの働きを阻害する化合物「HiP-8」の作製に成功した。2019年5月に、科学誌『nature』の姉妹誌『nature chemical biology』で発表された研究成果である。
「HiP-8は、がん細胞周辺で活性化される活性型HGFと特異的に結合し、活性型HGFがMET受容体と結合するのを阻害します。それにより、がん細胞の転移や浸潤、抗がん剤耐性獲得を防げると期待しています」
HiP-8は、がん治療薬への応用だけでなく、がんの画像診断への活用も期待されている。「HiP-8は、がん細胞周辺の活性型HGFと強く結びつきます。そのためHiP-8の存在は、がんの組織中に活性型HGFが存在している目印となります」
そこで松本教授らは、HiP-8を、放射性同位体(アイソトープ)を使う画像診断法PET(ポジトロン断層法)と組み合わせることを試みた。HiP-8に銅(Cu)の放射性同位体を標識してヒトがん細胞が移植されたマウスに投与したところ、期待どおり、活性型HGFが多く集まるがん細胞周辺に、HiP-8が集積していることを画像で確認することができた。この手法をヒトでも使えるようになれば、がんの新たな画像診断法につながると期待されている。
「同じ化合物を、がんの治療にも診断にも使えるのが画期的です。それが今回作成したHiP-8の大きなメリットです」と松本教授は力を込めた。
なお、HiP-8は、12個のアミノ酸が環状(リング状)に連結した「環状ペプチド」である(ペプチドもタンパク質も、いずれもアミノ酸がつながったもので、おおむねアミノ酸の数が50個以下の小さなタンパク質がペプチドと呼ばれる)。環状ペプチドは近年、医薬品としての可能性が大きく期待されている。
こうした「ペプチド医薬」の可能性の扉を開いたのが、松本教授の共同研究者である東大の菅教授だ。菅教授は、体の中でタンパク質が合成される基本的な仕組みと化学のテクノロジーを融合し、強い特異性と親和性で目的のタンパク質に結合する環状ペプチドを、従来とは比較にならないほど短時間に選び出す革新的な技術を開発した。
この技術は、菅教授も創業に携わったバイオベンチャー「ペプチドリーム」で創薬に活用され、同社は世界各国の製薬会社と共同研究を展開している。同社は2013年に東証マザーズに上場し、2015年には東証一部に市場変更した。この事実が、環状ペプチドへの期待の大きさを表している。
松本教授は、菅教授らとの共同研究で、HiP-8の作製成功前の2015年にも大きな成果を上げている。HGFの機能を代替する環状ペプチドの化学合成(以下、合成HGF)に成功していたのだ。
「HGFは、細胞が増殖したり、組織が正常に機能したりするのに必要なタンパク質です。その機能を代替する合成HGFは、細胞や組織の再生治療につながると期待しています」
実はそれ以前にも、松本教授は組換えタンパク質の技術を使い、組換えHGFを病気の治療薬として活用するため、2001年にバイオベンチャー「クリングルファーマ」を立ち上げた。クリングルとは、先にも触れたように、HGFの構造のことを指す(図1キャプション参照)。
先に触れたとおり、運動神経は、一度死んでしまうと復元しないのだが、HGFがあると、運動神経の生存が促進される。同社の組換えHGFを使って、日本国内で脊髄損傷とALSの治療薬として臨床試験が進んでいるほか、米国では急性腎障害の治療薬としての臨床試験が進んでいる。

ラボでは日々、さまざまな実験が行われている。
松本教授は、組換えHGFと合成HGFのそれぞれの可能性について次のように語る。
「組換えHGFは、脊髄損傷やALSの治療薬に向いています。分子サイズが大きく、脊髄に投与した組み換えHGFが長くとどまり、運動神経の生存を促すからです。一方、合成HGの特徴は、それがサイズの小さい環状ペプチドであることです。サイズが小さいゆえに組織に浸透しやすい可能性があります。そのため、組換えHGFが対象とする病気とは違った病気の治療に応用できると期待されます。組換えHGFよりも安価に製造することができるのも魅力です」
いずれの物質に対しても、松本教授は大きな期待を寄せている。
HGFを主なテーマに、がんの治療薬や画像診断の候補物質(HiP-8)の作製や、組換えHGFによる脊髄損傷やALSの治療薬開発など、医学分野で研究成果を上げている松本教授。だが意外にも、学生時代から医学を学んでいたわけではなかった。
「学生時代は理学部で植物の光合成を研究し、それで学位(博士号)を取得しました。その後、ひょんなきっかけから、大学病院の皮膚科で助手として勤務することになりました。その当時、皮膚科の診療ではなくあえて研究に従事する助手が求められました。しかし、医学部を卒業していない者で臨床の教室に飛び込もうとする人は誰もいませんでした。いつしか、私に声がかかりました」

医学への思いを熱く語る。臨床の現場で実感した医学の意義と可能性が、今も研究に取り組む原動力になっている。
このときの皮膚科での勤務経験が、その後の松本教授の進む道を決めることになった。
「臨床の現場を目の当たりにして、それまで学生時代に生物学の教科書で学んでいた平板な知識が、生身の体で起きている現象をサイエンスとして説明できるリアルな感覚を体感できました。その経験が僕にとっては大きなものでした。加えて、外来や病棟では、教授の脇で、病気に悩み苦しむ方の様子に接しました。“病気を治す”という医学の意義も深く実感しました。自分も誰かの病気を治す研究に貢献したい。そう強く思い、大学病院での4年間の勤務後、医療にもつながる基礎研究を続けています」
そして、大学病院を離れ、1990年に助手として着任した九州大学で、自身の研究テーマを決める大きな出会いがあった。そのとき師事した中村敏一教授(当時)こそ、HGFを発見した研究者だった。その影響で、松本教授もHGFの研究を始め、以来30年にわたってHGFの研究を続けている。
これまでの研究生活を振り返り、「まさか自分が医学の研究をすることになるとは……」と感慨にひたる。「大学院まで光合成の研究をしていて、皮膚科に行くことになったのは我ながら驚きです。その後の将来がどうなるかなんて想像もつきませんでした。後先を考えると不安になるだけなので、何かのチャンスと思って、思い切って飛び込みました」
その決断の先に、がんの治療薬や画像診断の候補物質(HiP-8)、脊髄損傷やALSの治療薬候補(組換えHGF)が生まれている。意思あるところに道は開ける。松本教授への医学への思いが、新たな道を切り開こうとしている。


本研究所は、国立大学附置研究所のなかで唯一、「がん研究」に特化している。1967(昭和42)年の設置以来、半世紀を超える歴史を有する。本研究所では、「がんの悪性化進展機構」に焦点を当てた研究を推進している。それにより、新しい診断・治療法の開発や臨床応用を通して科学の進歩に寄与するとともに、がんの克服による健康長寿社会の実現を目指している。
【取材・文:萱原正嗣 撮影:吉田亮人】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png