

糖尿病は、インスリンの作用不足によって引き起こされる。それが、これまでの糖尿病の「常識」だった。だが近年、糖尿病に関わるとされる「もうひとつのホルモン」に注目が集まっている。それがグルカゴンだ。
群馬大学生体調節研究所の北村忠弘教授は、グルカゴン研究の第一人者だ。グルカゴンの正確な測定法と解析、これを用いた糖尿病診断指標の確立と臨床への応用などに取り組んでいる。グルカゴンの新たな知見が、糖尿病の診断や治療に革命をもたらすかもしれない。

研究員や学生には「自由にやらせる」のが北村教授の指導法だ。自身が研究員時代、細かく厳しい指導と、自分の裁量に任せてもらえる指導の両方を経験しての判断だ。
糖尿病と診断された国内の患者数は1000万人を突破し、予備軍を含めると約2000万人を超える。厚生労働省の調査による2016年時点での推計だ。この数字は、北村教授が医学生だった30年前と比べて20〜30倍に増えている。当時は国民の100人に一人が糖尿病だったのに対し、現在は国民の6人に一人が発症している。過去50年でみると38倍も増加している。
糖尿病は自覚症状がなく、がんなどの重大疾患に比べて危機感が少ないことが予防や治療を遅らせている。北村教授は、その状況を踏まえて次のように警鐘を鳴らす。
「糖尿病になると、平均寿命が男性で8年、女性で11年も短くなることが分かっています。また、重症化すると合併症を発症し、やがて心筋梗塞や脳卒中といった寿命に影響する疾患につながるリスクが高くなるだけでなく、失明や下肢の切断、腎不全から人工透析が必要になるなど、その後の生活水準が格段に下がります」
糖尿病とは、血液中の血糖が慢性的に多くなり、高血糖の状態が続く疾患である。血糖はインスリンやグルカゴンといったホルモンの働きによって調節されている。糖尿病のなかで95%を占める2型糖尿病は、インスリンの分泌低下やインスリン抵抗性によるものと言われている。
インスリンは、膵臓のβ細胞から分泌され、血液中の糖を体内に取り込むことで血糖値を低下させるホルモンだ。一方のグルカゴンは、同じ膵臓のα細胞から分泌され、肝臓での糖産生を増やして血糖値を上昇させる働きがあり、血糖値が低下すると分泌される。インスリンとグルカゴンは、それぞれバランスを取りながら血糖値を一定に保っていることから、これまで「拮抗ホルモン」と捉えられてきた。
ところが、2010年と2011年に相次いで、グルカゴンに関する重大な発見があった。遺伝子改変動物を用いた基礎研究でのことである。
グルカゴンの作用が阻害されたα細胞欠損マウスやグルカゴン受容体欠損マウスは、薬剤投与によりβ細胞を破壊しインスリン分泌を阻害しても、正常な血糖値を維持することが明らかになった。さらに2012年には、血糖値の上昇には、インスリンの欠乏よりも、グルカゴンの上昇の方が重要であるとする「グルカゴン中心説」が発表されたのだ。
国内でも、2010年頃から、インスリン分泌促進だけでなく、グルカゴン分泌抑制作用を併せ持つ薬剤、インクレチン製剤が発売されたことで、あらためてグルカゴンに注目が集まるようになった。
「それ以前にも糖尿病の薬剤はたくさんありましたが、その多くがインスリンに効く薬でした。インクレチン製剤が臨床に登場したことで、グルカゴンに再び光があたり始めたのです」
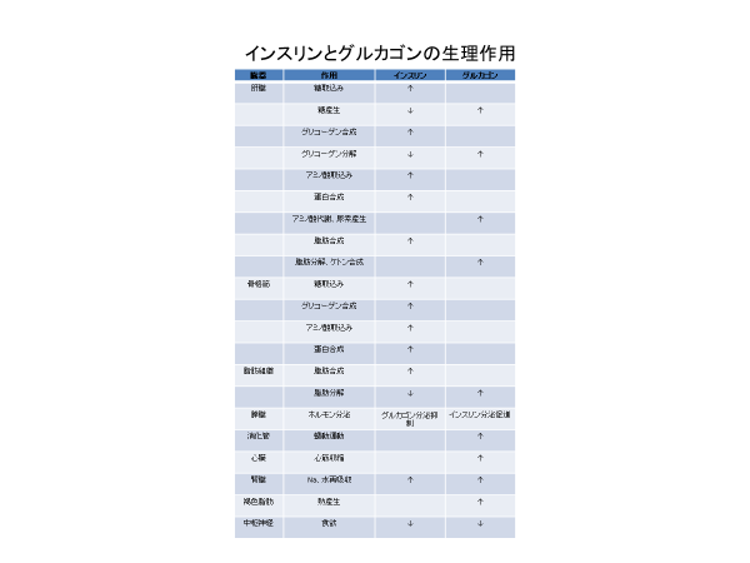
インスリンとグルカゴンの生理作用:インスリンとグルカゴンは逆向きの作用が多く、「拮抗ホルモン」であるように見えるが、腎臓におけるNaや水の再吸収、中枢神経系における食欲抑制については、同じ作用を示している。また、骨格筋にはグルカゴン受容体が発現せず、インスリンの骨格筋に対する作用にグルカゴンは拮抗していない。
グルカゴンはインスリンと同時期の1923年に発見されたが、インスリンに比べて研究が進まなかった。その理由として、北村教授はグルカゴン測定の不確かさにあったと指摘する。
「グルカゴンは、前駆体であるプログルカゴンから合成されます。その過程で、アミノ酸配列が酷似した複数のペプチドが産生されます。なかでも、グリセンチンやオキシントモジュリアンはアミノ酸配列がグルカゴンと重複していて、それらがグルカゴンと交差反応を起こすため、グルカゴンだけを正確に測定することが困難でした」

研究室では、遺伝子を操作したマウスを用いて、糖代謝機能やエネルギー代謝機能などの解析も行っている。
グルカゴンの測定には、これまでいくつかの方法が用いられてきた。従来よく用いられたのが、「競合法RIA」と呼ばれる測定法だ。この方法では、グルカゴンのC末端を認識する抗体が、グルカゴン以外のペプチドと交差反応を起こしてしまうのが問題だった。
これを克服するために新たに開発されたのが、「サンドイッチELISA法」と呼ばれる測定法だ。グルカゴンのC末端とN末端をそれぞれ認識する抗体で特異的に測定することができる。2つの抗体によりグルカゴンを「サンドイッチ」することからこの名で呼ばれた。この手法によりグルカゴンの測定精度は飛躍的に向上したが、精度の向上には原理的な限界があった。
その限界を克服するべく、北村教授は2017年に新たな測定法を企業の研究所と共同で開発した。「LC-MS/MS」という質量分析装置を用いた手法で、極めて高い精度でグルカゴンを特定できる反面、デメリットもあった。
「ひとつは検体の測定に時間がかかることです。複数検体を同時に測定できないため、1日最大でも20検体に限られました。加えて、高額な機器や実験にかかる人件費など、コストが高くなるのも弱点です。全ての検体をLC-MS/MSを使って測定できるわけではありません。技術革新が進むなか、安価で大量の検査ができる機器が登場することを期待しています」
測定精度とコストのトレードオフがあるなかで、北村教授らは、低コストでありながら、一定水準の精度を満たす測定法を探っている。同じ検体を、RIA法とサンドイッチELISA法、LC-MS/MSを用いて測定し、測定結果がどのような相関を示すかを調べたのだ。
その結果、従来の競合法RIAは、LC-MS/MSの結果とほぼ相関しないことが明らかとなった。これまで測定されてきた値は、グルカゴンの他にもさまざまなものを含有していた可能性があり、それがグルカゴンの臨床的な解釈を困難にしていたと考えられる。
一方のサンドイッチELISA法は、測定値に完全な一致は見られないものの、LC-MS/MSの結果と良好な相関を示すことが確認できた。そのため、今後のグルカゴン測定にはサンドイッチELISA法を用い、過去に実施されたグルカゴンの測定データを再評価していく考えだ。その結果をもとに、糖尿病の病態把握につなげていくことを目指している。
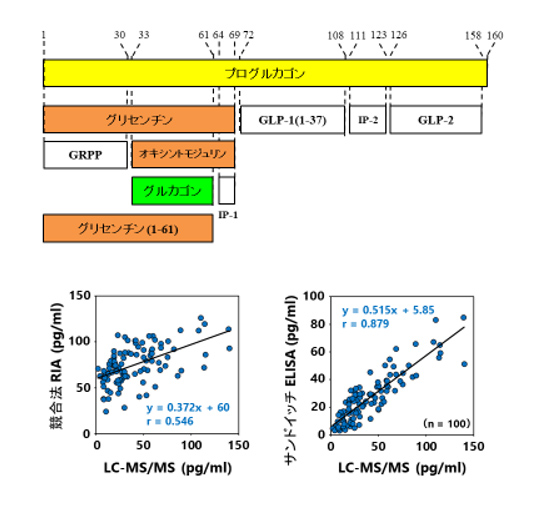
グルカゴンの構造と測定法比較:(上)プログルカゴンから産生される種々のグルカゴン類縁ペプチド/(下)LC-MS/MS法とサンドイッチELISA法、または競合法RIAとのグルカゴン測定値の相関
LC-MS/MS法は測定時間とコストの面で多検体の測定が難しく、汎用性に乏しい。これらの問題がクリアできれば、将来的にはLC-MS/MS法による測定が標準になる可能性がある。
これまでの研究から、2型糖尿病の患者では、インスリンの分泌低下とともに血中グルカゴン濃度が高くなることが指摘されている。だが、従来のRIA法で検出された2型糖尿病患者の血中グルカゴン濃度は、健常者に比べて軽度の上昇であり、それが有意な差であるかを特定することが難しかった。
また、2型糖尿病では、はじめにβ細胞機能障害(インスリン分泌低下)が起こり、二次的にα細胞機能障害(グルカゴン過剰分泌)が起こるとされてきた。ところが、サンドイッチELISA法を用いてグルカゴンを測定すると、いまだ糖尿病を発症していない「境界型」の段階からも、血中グルカゴン濃度が上昇していることが明らかになった。

消化器内科医を目指していたが、医局の教授が糖尿病の研究者だったことから、自然な流れで糖尿病研究の道へ。研究が面白くなり、さらに発展させようと米国留学した先の教授も糖尿病の研究者だった。研究を始めてみると解明されていないことが多く、北村教授は研究に夢中になっていったという。
また、2型糖尿病の早期から、α細胞数が増えることも確認された。
なぜ2型糖尿病でα細胞数が増え、グルカゴン濃度が上昇するのか――。そのメカニズムは未だ解明されていないが、糖尿病の病態にα細胞の異常が関わっているのは間違いなさそうだ。北村研究室では、α細胞機能に関わるさまざまな遺伝子を改変したマウスを作製し、分子レベルでのメカニズム解明を目指している。
今後さらに研究を前進させるには、2型糖尿病患者の血中グルカゴン濃度を精度よく測定・解析することが必要だ。現段階では、サンドイッチELISA法を用いたグルカゴン測定例自体がまだまだ少ない。
「私自身も学会などで臨床の先生方にグルカゴンへの知識を深めてもらい、グルカゴン測定の意義を伝えていますが、まだまだ測定数が足りません。解析を進めるなかでグルカゴンの役割が明らかになってくれば、測定の重要性についても理解していただけると思います」
北村教授が見据えているのは糖尿病の個別化医療だ。
「病態を把握するためにも、判断材料は多いに越したことはありません。血糖値、インスリンという指標にグルカゴンが加わることで、病態を的確に判断できるようになり、将来的には糖尿病の個別化医療が可能になります。ただし、研究の先にあるのは常に患者であり、人の治療につながることが重要です。研究で得た知見を治療に反映させ、治療から得た成果を研究にフィードバックさせる。それこそが、本研究所の役割だと考えています」
インスリンが欠乏することで糖尿病を発症すると考えられてきたこれまでの常識を覆し、グルカゴンの再評価が起こり、新たな知見が増えつつある。北村教授の研究は、よりよい診断法・治療法の確立にもつながっていくことだろう。グルカゴンへの理解は、糖尿病治療を大きく変えるかもしれない。


1963年に設立された内分泌研究所から、国内唯一の内分泌・代謝学を専門とする基礎医学研究所として1994年に生体調節研究所へと改組。内分泌・代謝システムをはじめ、分子メカニズムを解明し、糖尿病や肥満症、がんなどの生活習慣病に対する予防法や治療法の開発に取り組んでいる。インスリンやグルカゴン等の内分泌ホルモンの研究だけでなく、脂肪細胞の新たな生理機能の研究、ゲノム編集を用いた新しい代謝制御技術の開発のほか、脳が摂取行動を決める仕組み、生活習慣病と脳疾患の関わりについても研究を実施。伝統的な内分泌・代謝研究と最先端の基礎医学研究を2つの柱として有機的に連携させ、次代の内分泌・代謝学を切り開く。
【取材・文:但本結子 撮影:カケマコト】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png