

「腸内細菌」の存在は、いまや広く知られるようになった。だが、体内に自己ならざる生命体が生息していることは、実に不思議なことである。自己を防衛する免疫の働きにより、本来なら異物は排除されるはずだからだ。
千葉大学真菌医学研究センターの後藤義幸准教授は、腸内微生物と免疫の関係を研究している。微生物はいかにして腸内に生息しているのか。それが健康や病気とどう関わるのか。そのナゾを解くカギは、腸内に広がる豊かな生態系が握っていた。
私たちヒトは、無数の微生物とともに生きている。皮膚の表面や口・鼻・喉・消化管の粘膜など、ヒトの体のあらゆるところに多数の細菌が住み着いている。なかでも多くの細菌がいるのが腸内だ。その数は100兆とも1000兆とも言われ、人体を構成する約37兆個の細胞よりはるかに多い。
「腸内には、数百~1000種類にも及ぶ細菌が住み着いています。それらは大きく3つのグループに分けられます。ヒトに有用な働きをする『善玉菌』、体に悪い影響を引き起こす『悪玉菌』、普段は何も悪さをしないものの、体が弱ると悪影響を及ぼす『日和見菌』です。善玉菌の代表例はビフィズス菌や乳酸菌、悪玉菌の代表例がディフィシル菌やウェルシュ菌などです」と後藤准教授は説明する。

研究室で、学生たちと談笑する後藤准教授。生物の営みは、研究者たちの日々の実験の積み重ねによって明らかにされる。
この「腸内細菌」は、近年さまざまなメディアで注目されるようになっている。それは、ヒトの健康や病気と深く関わっていることが研究で明らかにされてきたからだ。
「健康なヒトの腸内にも、善玉菌と悪玉菌、日和見菌がバランスを保ちながら生息していますが、そのバランスが崩れると悪玉菌や日和見菌の働きが活発になります。この状態を『ディスバイオーシス』と呼び、それがさまざまな病気を引き起こしていることが明らかになってきています。腸の疾患や感染症だけでなく、生活習慣病やアレルギー、がん、精神神経疾患といった病気も腸内細菌が関係していると報告されています」
さらに近年の研究では、腸内細菌がより重要な役割を果たしていることも明らかにされている。
「マウスを実験的に無菌状態で育てると、個体が正常に生育しないことが分かっています。腸管の形が変わり、免疫の働き方にも異常が見られます。おそらく私たちヒトも同様で、菌の存在を前提に体がつくられています。菌が存在しなければ、私たちはまともに生きていくことができないと言うこともできるのです」
こうした一連の発見は、生命の「個体」に関する概念を大きく揺さぶった。ヒトは一個の独立した生命体であると思われていたが、実は無数の生命体の集まりだった。1958年に微生物の研究でノーベル生理学・医学賞を受賞したジョシュア・レーダーバーグ博士は、2000年に米国の科学誌『Science』で、このことを「スーパーオーガニズム(超生命体)」という言葉で表現した。「人間はヒトの細胞と微生物で構成されているスーパーオーガニズム(超生命体)である」と述べたのだ。
それを裏付ける発見も次々となされ、ヒトの健康や病気を考えるにあたっては、こうした微生物を含めた「生態系」として捉えることが一般的になっている。
腸内に無数の細菌が住み着いていることは、今では広く知られるようになった事実だが、ヒトの体の仕組みを考えると実は不可思議だ。ヒトを含む多くの生物には、体内に異物が入ってくるのを拒む「免疫」の仕組みが備わっている。
免疫を司る細胞(免疫細胞)は、なぜ異物である細菌の存在を許すのか――。後藤准教授は、その仕組みの解明に挑んでいる。
そもそも免疫とはどのような働きなのか。後藤准教授は、「免疫学は大きく2つのコンセプトで成り立っている」と語る。
「まず重要なのは、“自己”と“非自己”の識別です。自分の細胞とそれ以外の細胞や物質を区別して認識し、“非自己”を『排除』して“自己”を守っています。この働きがあるからこそ、細菌やウイルスに感染した場合でも、それらを認識して撃退しようと試みます。なお、発熱や嘔吐・下痢などの感染症による症状の多くは、異物を排除しようとする免疫反応の結果です」

免疫の不思議な働きを説明する後藤准教授。腸管免疫細胞が、腸内の細菌に対し、「共生」と「排除」を見極めるメカニズムを研究している。
だが、特に腸内の免疫には、非自己を「排除」する以外にも重要な働きがある。それが、准教授が掲げた2つ目のコンセプトだ。
「腸管では、特有の免疫システムが働いています。それは、多くの生物が『食べる』ことで生命を維持していることと深く関係しています。ヒトが食べるものは、基本的には植物か動物、要するに“非自己”です。それを胃腸などで分解し、腸から栄養素を摂取しています。それが成立するのは、腸管の免疫細胞が経口摂取されたものへの免疫反応を抑制する仕組みが働いているからです。それを『寛容』といい、腸管免疫細胞は異物を見極めて、『排除』か『寛容』かの反応を変えています。さらに腸管の免疫システムに特有なのが、腸内に細菌を住まわせる『共生』の働きです」
免疫細胞はこのようにして、“非自己”である異物に対して、「排除」と「寛容」と「共生」を巧妙に使い分けている。経口摂取したものには、「排除」すべき微生物が付着していることもあるし、「共生」させるべき微生物が付着していることもあるだろう。腸には食べものに付随して、実にさまざまな“非自己”がやってくる。それを絶えず識別するためだろうか、腸は体内の免疫細胞の6割もが集中する最大の免疫臓器である。
後藤准教授は、腸管免疫細胞が“非自己”をどのように識別し、「排除」「寛容」「共生」と反応を変えているのか、そのメカニズムを研究している。
免疫細胞がどの細菌を共生させ、どの細菌を排除しているのか――。
「そのメカニズムは、免疫細胞と腸内細菌の関係だけでは説明できない」と後藤教授は話す。その選別には、腸の免疫機能を担うもうひとつの重要な細胞組織、「腸管上皮細胞」が関わっているというのだ。
話が少し複雑になるが、「腸の中」は「体の外」にあたる。口から食べたものは、食道を通って胃腸に届き、そこで消化・吸収され、体内に吸収されなかったものが肛門から排泄される。すなわち私たちヒトは、マカロニと同じように、中央に穴が空いた「一本の長い管」になっているわけだ。
「上皮細胞」は、体内への異物(非自己)の侵入を阻む第一関門を担う。腸だけでなく全身にあり、体表を覆う表皮細胞や、腸管の表面を覆う腸管上皮細胞が代表例だ。
口から肛門までの管の表面を上皮細胞は、粘液を分泌したり抗菌物質を産生したりして異物の侵入を阻止する。腸管上皮細胞は腸の防衛最前線を担い、異物ともっとも多く接する器官である。腸管に免疫細胞の6割が集中するのもそのためだろう。
後藤准教授が注目するのは腸管上皮細胞表面の「糖鎖」だ。この糖鎖の先端には、「α1, 2-フコース」と呼ばれる糖があり、腸内細菌が共生するときの大きな要因になっていると考えられている。
「腸内に共生している乳酸菌のような細菌は、α1, 2-フコースを切り取って、それを自身の栄養源として利用することができます。マウスを使った実験でそのことが1990年代に報告され、フコースが腸内細菌の共生因子と考えられています」
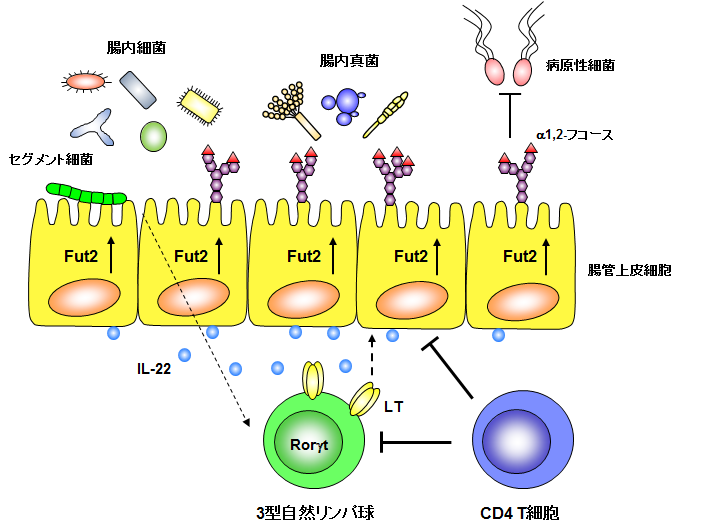
腸管上皮細胞(中央黄色)と腸内細菌(上部)と免疫細胞(下部の緑と青)の関係。セグメント細菌と呼ばれる腸内細菌が免疫細胞に働きかけ、免疫細胞が腸管上皮細胞に対してα1, 2-フコースの発現を誘導する。Fut2とは、α1, 2-フコースを糖鎖に付加する酵素のこと。図版は後藤准教授提供。
後藤准教授は自身の研究で、フコースが発現するメカニズムを調べたところ、さらに興味深い事実が見えてきた。無菌環境下で育てたマウスの腸管上皮細胞にはα1, 2-フコースが存在せず、α1, 2-フコースは、多くの菌がいる通常環境下で育てたマウスでしか確認できなかったのだ。
「通常環境下では、食べものを介して腸内に細菌が侵入してきます。その細菌のなかに、フコースの発現を誘導するものがいることが分かりました。それらの細菌は免疫細胞に働きかけ、免疫細胞がフコース発現を誘導しています。なかには、フコース発現を誘導して自身のエサにするものもいれば、フコース発現を誘導するもののエサとしては利用しないもの、さらには自身ではフコース発現を誘導できず、フコースを利用するだけのものもいます」
この、腸管上皮細胞のα1, 2-フコースが腸内細菌と免疫細胞の連携によって発現するという発見は、2014年に科学誌『Science』で掲載された。研究を始めて7年越しの成果だ。しかも驚いたことに、その直後に2つの研究グループが、別の科学誌で同様の研究成果を発表したのだそうだ。ライバルグループもフコースに注目し、同じ研究を同時期に進めていた証である。その競争に、後藤准教授はタッチの差で先んじることができたのだ。
一方、病原性細菌はフコースをエサとして利用することができない。フコースを利用できる細菌が腸内環境で有利になり、病原性細菌の繁殖を押さえていると考えられるという。
「こうした一連の研究で、腸内細菌と免疫細胞、そして腸管上皮細胞の3つの細胞群が連携してフコース発現を誘導し、腸内細菌のバランスを保っていることが見えてきました」
その後、後藤准教授がマウスで行った実験では、α1, 2-フコースが病原性細菌の排除に積極的に関わっている可能性も見えてきた。
「マウスを遺伝子改変し、腸管上皮細胞でα1, 2-フコースが発現しないようにしたところ、通常のマウスと比べてサルモネラ菌に感染しやすくなりました。フコースの存在が、サルモネラ菌の感染防御に一定の効果を果たしていると思われます。フコースは、共生細菌にはエサとなり、病原性細菌にはエサにならないばかりか、それによって自身が排除される。腸管上皮細胞のα1, 2-フコースが、細菌の種別によってアメとムチのように働き、その結果、腸内で共生できる細菌と排除される細菌が選別されていると考えられるのです」

目では見えない微生物を見るには顕微鏡が欠かせない。画面に写っているのは、α1, 2-フコースを染色したマウスの腸。
ここまではマウスでの話だが、α1, 2-フコースは、ヒトの腸管上皮細胞にも存在する。そして、α1, 2-フコースを糖鎖の先端に付加する酵素Fut2の異常は、いくつかの病気の要因だと考えられている。
「クローン病、I型糖尿病、原発性硬化性胆管炎など、ある種の自己免疫疾患と呼べる慢性の炎症性疾患の患者の多くは、Fut2をつくり出す遺伝子に変異が見られます。すなわち、糖鎖の先端にα1, 2-フコースがないヒトは、これらの病気になりやすい。一方で、α1, 2-フコースがあるヒトは、消化器障害を引き起こすノロウイルス感染症やロタウイルス感染症にかかりやすいとの報告があります。これらのウイルスが細胞に感染する際、フコースをレセプター(受容器)として使っているからです。つまり、α1, 2-フコースを持たないヒトは、ノロウイルスやロタウイルスに感染しにくくなるわけです。α1, 2-フコースの有無により、かかりにくい病気やかかりやすい病気が変わる。この生物学的トレードオフシステムを、興味深く捉えています」
「さらに……」と後藤准教授は付け加える。
「ヒトでもマウスと同じように、フコースの発現に腸内細菌が関わっている可能性があります。つまりヒトでも、腸内細菌が免疫細胞に働きかけ、免疫細胞が腸管上皮細胞と連携し、腸管上皮細胞にフコースを発現させているのかもしれません。マウスではフコースが細菌に対してアメとムチのように働き、ヒトではフコースの有無が、どの病気にかかりやすくなるかのトレードオフとして作用する。それを規定しているのが腸内細菌だとすると、腸内細菌との関わりを調べることは、ヒトの健康や病気を考えるうえで非常に重要なポイントになってきます」
後藤准教授が所属する真菌医学研究センターは、我が国唯一の真菌医学の総合研究拠点だ。
「真菌」とは、キノコやカビ、酵母などが分類される菌類の一種だ。細胞内に核を持たない原核生物である細菌と異なり、菌類は私たちヒトと同じく細胞内に核を持つ真核生物だ。菌類も核の中に染色体を格納し、核のほかにもミトコンドリアや小胞体など多くの小器官を持っている。
腸内細菌を研究してきた後藤准教授が当センターに所属しているのは、真菌と腸内細菌の関係についても研究しているからだ。
「ヒトの腸内にも真菌が存在していることは分かっていますが、その実態はほとんど解明されていません。特に日本人の腸内真菌については、近年になって初めて論文が出たばかりでほぼ手つかずの研究分野です。私は腸内真菌のなかで、カンジダ・アルビカンスという真菌に着目しています」
カンジダ・アルビカンスは、皮膚や女性の膣などに存在していることが知られていた。普段は何も起こさないが、体調が悪い時などにカンジダ症を引き起こす、「日和見感染」を起こす真菌だ。この真菌が、日本人の腸の中にも存在していると報告されたのだ。

腸内に生息する細菌の多くは酸素を嫌う嫌気性だ。酸素の混入を防ぐため密閉された空間内に手を入れて作業する。菌が外に漏れ出ることも防ぐ意味がある。
後藤准教授はカンジダ・アルビカンスをマウスに投与し、腸内での振る舞いを調べてみたことがある。准教授は、ヒトと同じようにマウスの腸にもこの真菌が定着すると推測していたが、結果はそうではなかった。投与直後は増殖が見られるものの、徐々に少なくなって最終的に菌が検出できなくなった。
だが、マウスに抗生物質を投与し腸内細菌を殺すと、結果は変わった。カンジダ・アルビカンスが増殖し、腸内に定着したのである。この実験結果は、マウスの腸内細菌がカンジダ・アルビカンスを排除し、定着を阻害していた可能性を示唆している。
「腸内細菌が真菌の感染防御にも一役買っているとすると、創薬への応用が期待できます。感染防御に重要な役割を果たしている腸内細菌を特定できれば、その細菌を単離して治療に役立てることもできます。たとえばその細菌の製剤をつくる、もしくは細菌が出す物質を薬にして飲んでもらう。ヒトの体内にいる微生物叢のことをマイクロバイオームといい、それを創薬に活かすことを『マイクロバイオーム創薬』と呼びます。私たちの研究室でもさまざまな腸内細菌を分離して、創薬につながる菌を探しています」
後藤准教授は、なぜこの分野の研究を志したのだろうか。
その理由を尋ねると、「感染症にかかりやすい体質で、微生物学や免疫学に興味を持った」からだという。東北大学で免疫学の基礎を学び、修士課程で腸の免疫メカニズムに興味を持った。博士課程に進むと、腸の免疫細胞がどのように共生細菌と病原性細菌を見分けているかのメカニズムが解明されていないことを知り、その研究にのめりこんだ。
「私たちの腸の中には細菌や真菌が数多く生息し、想像もつかないほど複雑な生態系が形成されています。非自己であるはずの微生物は、私たちヒトの細胞と、あるいは微生物どうしで相互作用して生きています。そうした微生物の働きが、私たちヒトの健康の支えになっています。この複雑な生態系については、分かっていないことばかりです。無数にいる腸内の微生物には、一つひとつ何らかの役割や意味があるはずです。それを研究することで、新たな薬が生まれ、生命現象を解き明かす重要な手掛かりを得られるかもしれません」
腸は、ヒトの体内に広がる膨大なフロンティアと言えるのだろう。


我が国唯一の真菌医学総合研究拠点として、基盤研究、臨床研究、共同研究、人材育成に取り組んでいる。真菌学、真菌免疫学、粘膜免疫学、バイオインフォマティクス(生命情報科学)などの多分野の研究者による、学際的な次世代真菌医学の創成を目指している。また、千葉大学附属病院に国内初の「真菌症専門外来」を開設し、全国の医療機関に対してさまざまなコンサルティングサービスを提供している。
(写真はセンター提供)
【取材・文:萱原正嗣 撮影:カケマコト】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png