

自分の性格や行動が、体内に寄生する微生物に支配されている……。そんなSFのような話がありうると、近年の研究で指摘され始めている。
その微生物の名は、「トキソプラズマ」。ヒトを含む哺乳類や鳥類に感染する「原虫」で、世界の3人に1人がトキソプラズマに感染しているとの推計がある。最新の研究では、トキソプラズマに感染している人は非感染者よりリスク許容度が高く起業志向が強い、サッカーで攻撃的なスタイルをとる強豪国で感染率が高いなど、感染と性格の相関関係が報告されている。帯広畜産大学原虫病研究センターの西川義文教授は、トキソプラズマをはじめ、さまざまな原虫感染症の研究に取り組んでいる。
トキソプラズマは、ヒトを含む哺乳類や鳥類に感染する「原虫」という微生物だ。大きさはわずか数マイクロメートルほど。肉眼で見るのはまず不可能だ(肉眼で見られる限界は0.2ミリメートル、すなわち200マイクロメートル程度とされている)。
原虫とは「単細胞の真核生物(細胞内に核を持つ生物)」のことだ。動物体内に寄生して増殖し、病原性を持つものも多い。原虫感染症でもっとも知られているのはマラリアだろう。蚊がマラリア原虫を媒介し、毎年世界で3~5億人が感染し、150~270万人が命を落としているとWHO(世界保健機関)は推計している。

研究室で学生の実験を見守る西川教授。研究室には教授を入れて15名ほどが在籍し、そのうち3分の1が留学生だ。写真の女性もフィリピンからの留学生。
トキソプラズマのヒトへの感染は、ヒトの性格や行動を左右する可能性が、近年の研究で相次ぎ報告されている。米国コロラド大学などによれば、感染者は非感染者と比べて失敗を恐れる気持ちが低く、すなわちリスク許容度が高く、起業志向が強い傾向があるとのこと。米国スタンフォード大学の研究では、トキソプラズマの感染率が高い国には、ブラジル(感染率67 %)・アルゼンチン(同52 %)・フランス(同45 %)・スペイン(同44 %)・ドイツ(同43 %)などサッカー強豪国が多く、攻撃的なプレースタイルとの関係が示唆された。
それだけではない。西川教授は、トキソプラズマの感染がヒトの精神や神経にさまざまな影響を与えている可能性についても触れた。
「感染者は交通事故を起こしやすいほか、自殺率が高いなどの報告もなされています。また、感染が統合失調症やアルツハイマー、パーキンソン病などの神経・精神疾患のリスク要因になることも報告されています」
なぜこのようなことが起こるのか――。西川教授は、その謎に迫る研究に取り組んでいる。
ラットやマウスなどネズミにとって、ネコは自身を捕食する天敵だ。そのためネズミは先天的にネコの尿の匂いを嗅ぎ分け、ネコを避ける性質を備えている。だが、トキソプラズマに感染したネズミは、ネコへの警戒感が弱まることが報告されている。
そのほかにも、空間記憶や学習能力が低下し、不安や恐怖に対して鈍感になること、トキソプラズマに感染したオスは、メスから繁殖相手として選ばれやすいことなどが、実験で明らかにされている。
いったいなぜなのか――。その理由を西川教授は次のように語る。
「トキソプラズマは、ヒトを含む哺乳類と鳥類、ほぼすべての恒温動物に感染します。なかでもトキソプラズマの生存・繁殖にとって重要なのはネコへの感染です。トキソプラズマは複雑な増殖サイクルによって子孫を増やしていきます。その繁殖サイクルを完成させるには、ネコへの感染が不可欠です。そのためトキソプラズマは、ネコの捕食対象であるネズミの行動を変え、自身が生存・繁殖しやすくしていると考えられています。これを『トキソプラズマの宿主ハイジャック機構』といいます」
「宿主」とは、病原体が感染した生物のことを指す。繁殖に不可欠な宿主のことを「終宿主」、それ以外の宿主を「中間宿主」という。トキソプラズマの場合はネコが終宿主、ヒトをはじめネコ以外の哺乳類や鳥類は中間宿主である。

電気泳動によってDNAやタンパク質を分離する実験。細かい実験の積み重ねが、論文や大きな成果へとつながっていく。
ではなぜ、ネズミの行動変化が起こるのか。
トキソプラズマの感染は、マウスの行動変化だけでなく、うつ症状や記憶障害などの神経・精神疾患も引き起こす。西川教授らの研究グループは、こうした変化のメカニズムを解明するため、感染マウスの脳組織で、遺伝子発現がどのように変化するかを解析した。その結果、大きく2つのことが見えてきた。
「ひとつは、感染マウスで免疫反応を活性化させる遺伝子の発現が上昇し、脳で過剰な炎症反応が起きていること。もうひとつは、神経機能を司る遺伝子の発現が低下していることです。過剰な炎症反応と神経機能の低下によって、脳が何らかの影響を受けているのは間違いなさそうです。また、感染による病変が脳のどの部位に現れるかを調べてみると、高度な脳機能を担う前頭前野が大きな障害を起きていることが分かりました。こうしたことから、感染によって脳機能が障害を受け、行動や性格の変化、さまざまな神経・精神疾患が起きていると考えられます」
ヒトの場合も、マウスと同様、感染によって脳機能が障害を受けている可能性が高いとのことだ。
トキソプラズマは、一生のなかで幾度も形態を変える。さらには繁殖の方法さえも変わる。そのサイクルは、おおよそ次のようなものだ(図とあわせて参照。実際はさらに複雑で、以下の説明も大幅に簡略化している)。
トキソプラズマは、終宿主であるネコの消化器官においてのみ有性生殖する。トキソプラズマの生活環(一生のサイクルのこと)において、ネコへの感染が重要なのはそのためだ。
この有性生殖から、「オーシスト」と呼ばれる形態の子孫が生まれてくる。オーシストは、ネコの糞便によって体外に放出され、土壌や水の中に紛れ込む。オーシストは、ネコ以外の哺乳類や鳥類が土壌中の餌を食べ、あるいは水を飲むときに経口感染する。
オーシストが哺乳類や鳥類に感染すると、「タキゾイト(急増虫体)」と呼ばれる形態に姿を変えて急激に増殖する。
その後しばらくすると、宿主の免疫反応によってその増殖は抑えられるが、それに伴い今度は「ブラディゾイト(緩増虫体)」と呼ばれる形態に変化する。ブラディゾイトは、免疫反応の及びにくい中枢神経系や筋組織に潜伏し、多数集まってコロニーのような塊を形成する。この塊を「シスト」と呼ぶ。

トキソプラズマの生活環(一生のサイクル)とヒトへの感染経路。ネコの腸管内で有性生殖により「オーシスト」(図中の楕円形状のもの)が生まれ、その他の哺乳類や鳥類に感染する。オーシストは「タキゾイト(急増虫体)」(図中の三日月型のもの)に、タキゾイトは「ブラディゾイト(緩増虫体)」に変化し、ブラディゾイトが集まって「シスト」(図中の丸型のもの)を形成する。
トキソプラズマは、これらいずれの形態においても感染力がある。そのため、トキソプラズマに感染した宿主個体の肉をそのまま食べると、肉を食べた個体にもトキソプラズマは感染することがある。
「ブタやウシ、鳥などの肉にはトキソプラズマが潜んでいることがあります。それらを十分に加熱せずに食べると、ヒトにも感染するリスクがあります。また、土壌中のオーシストを手で直接触わり、あるいは野菜などに付着したものを食べることでもトキソプラズマはヒトに感染します」
トキソプラズマがヒトに感染しても、重篤な症状を引き起こすことは稀だ。健常な成人なら、風邪に似た症状が出る程度だ。
だが先に見たように、トキソプラズマはヒトの脳機能にダメージを与える可能性がある。また、妊婦に初めて感染した場合は、胎児に重大な症状を引き起こしかねない(詳細は後述)。「そのためトキソプラズマは『顧みられない感染症』とも言われ、WHOや世界各国の保健機関が、環境へのオーシストの広がりを公衆衛生上の課題として強く認識し始めています。また、生肉食やガーデニング、終宿主であるネコとの接触についても、さまざまな注意喚起が行われるようになってきています」
身近なところに、トキソプラズマへの感染リスクが潜んでいるのだ。
ここで、トキソプラズマがヒトに感染した場合の症状について詳しく見ていこう。
健康な成人の場合、重篤な症状を引き起こすことはきわめて稀だ。それが、長く「顧みられない感染症」とされてきた所以である。西川教授は、その認識を改める必要性を強く指摘した。
「乳幼児への感染は、脳炎や網膜炎、心筋炎などを引き起こします。また、妊婦が初めて感染すると、流産や死産、胎児の水頭症など、さまざまな症状につながります。成人でも免疫力が低下すると、感染後に体内に潜んでいたトキソプラズマが暴れ出し、脳炎などの症状を起こすことがあります。免疫力の低下は、がん治療のための化学療法や臓器移植の際の免疫抑制剤投与、あるいは、HIV(ヒト免疫不全ウイルス)の感染によるAIDS(ヒト免疫不全症候群)の発症など、さまざまな理由によって起こりえます」
トキソプラズマは、世界人口のおよそ3人に1人が感染していると推計されている。重篤な症状の有無にかかわらず、感染の広がりを防ぐことが大きな課題となっているのだ。

トキソプラズマの感染リスクや感染メカニズムについて語る西川教授。
2018年現在、トキソプラズマに対しては、いくつかの治療薬や予防のためのワクチンが存在するが、対策としては十分ではない。その理由を西川教授は次のように語る。
「効果があるのはタキゾイト(急増虫体)に対してのみで、シストを形成したブラディゾイト(緩増虫体)に対しては効果がありません。シストは厚い壁で覆われており、薬剤が細胞にまで届かないからです。そのため、体内に定着したブラディゾイトを取り除くことは今の技術では不可能です。また、感染症の治療薬は、病原体の代謝経路を阻害することで効果を発揮します(代謝とは生体内で起きる化学反応全般を指す)。トキソプラズマの治療薬は、宿主と共通の代謝経路を標的としているため、宿主の正常な生体反応にも悪影響を与える副反応のリスクがあります。ヒツジ用のワクチンが海外で使用されていますが、ヒトに対して安全性と有効性が確認されたものは存在していません」
西川教授は、こうした状況を打破するべく、治療薬やワクチンの開発に取り組んでいる。
最先端の研究も、人の手によって支えられている。
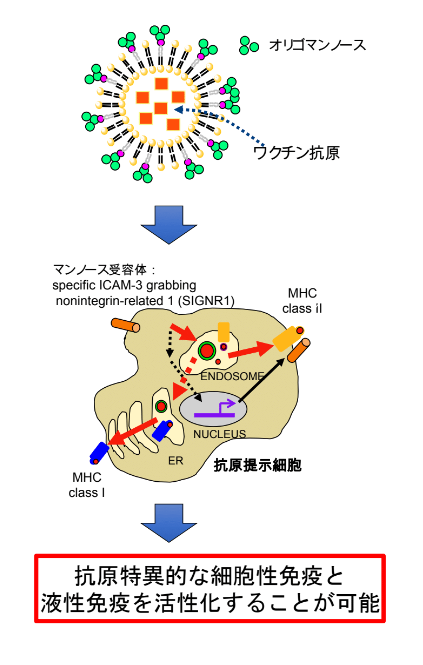
脂質膜の表面にオリゴマンノースを付着させ、免疫細胞(マクロファージや樹状細胞)に認識させる。脂質膜の内部にはワクチン抗原(この場合はトキソプラズマやマラリア原虫の一部)を封入し、免疫細胞に抗原を認識させる。
西川教授の研究のなかで、実用化にもっとも近いのがワクチンだ。
そもそもワクチンとは、病原体の感染に備えて“疑似的な病原体”をあらかじめ人為的に接種し、体内の免疫システムを活性化することで感染・発症を防ぐものだ。
ワクチンは大別すると、生きた病原体の病原性を弱めた「生ワクチン」と、病原体を不活化させた(すなわち死んだ病原体を使う)「不活化ワクチン」の2種類がある。ワクチンには安全性と有効性のトレードオフがあり、前者の方が有効性は高いが安全性での課題があり(体内で病原性が復活するリスクなどがある)、後者の方が安全性は高いものの有効性がいくらか犠牲にされている。
免疫システムは、病原体を「抗原」として認識し、体内で迎撃体制を確立する。その主役は、抗原そのものを攻撃する「抗体」と、病原体が感染した細胞を細胞もろとも破壊する「細胞傷害性T細胞(略称CTL、キラーT細胞とも)」である。
不活化ワクチンは、抗体を効果的に誘導することができるが、CTLの誘導は限定的だ。そのため、細胞内に寄生する原虫感染症への対策としては不十分だ(細胞内に潜伏感染している原虫を取り除くことができない)。
「CTLを効果的に誘導するには、マクロファージや樹状細胞と呼ばれる免疫細胞に、まず抗原を認識させる必要があります。これらの免疫細胞は、抗原を細胞内に取り込み、抗体産生やCTLの活性化を促します。安全性を重視した不活化ワクチンは、これらの免疫細胞を十分に活性化させることができないのが弱点でした」
一方の生ワクチンは、抗体とCTLの両方を効果的に誘導することができるが、病原性が復帰するリスクがある。西川教授らは、CTLを効果的に誘導可能で、かつ安全性も確かな原虫感染症ワクチンの開発に挑んでいる。
西川教授らが開発に取り組むワクチンの技術の鍵は、東海大学工学部生命化学科の小島直也教授と黒田泰弘准教授が開発した特殊な脂質膜にある。
「私たちが開発した特殊な脂質膜の表面には、マクロファージや樹状細胞が抗原を認識する手掛かりのひとつである『オリゴマンノース』と呼ばれるオリゴ糖を付着させています。その脂質膜の中に、トキソプラズマの抗原の一部を封入してマウスで反応を見る実験を行いました。結果は狙い通り。マクロファージや樹状細胞に、脂質膜表面のオリゴマンノースを認識して脂質膜を細胞内に取り込み、抗原を認識させることに成功しました。CTLも効果的に誘導され、トキソプラズマ感染症のワクチン製剤候補として今も研究を続けています」
さらに、同じ仕組みでマラリア原虫やその他の原虫感染症の抗原でも同様の実験を行い、同じようなポジティブな成果が出た。2014年には、マラリア原虫とトキソプラズマでワクチンの効果を確認した論文を発表。その後、ウシに感染する原虫感染症の対策研究として、マウスモデルの次のステップ、ウシでの実証実験にも取り組んでいる。
一般的に、原虫感染症は家畜に経済的損失をもたらすものが多い。開発途上国における家畜疾病上位20のうち、1位から3位までと10位台の2つは原虫感染症だ(2000年の調査)。
帯広畜産大学原虫病研究センターは、日本で唯一の原虫病に特化した研究機関である。センターは、ヒトと家畜の原虫病を制圧するべく、先端研究に加えて国際共同研究や国際協力にも力を入れて取り組んでいる。
「ヒトでも家畜でも、原虫感染症の被害が大きいのは主に開発途上国です。そのため当センターでは、アジア・アフリカ各国の研究機関と学術交流協定を結び、国際共同研究を数多く展開しています。これまでにも、センターで開発した診断技術を用いて各国で大規模な疫学調査を実施し、原虫感染症の分布と被害の実態解明に取り組んできました。また、途上国で活躍できる人材を育成するため、JICA(国際協力機構)と連携し、途上国から若手・中堅研究者も積極的に受け入れています。2018年までに、累計37ヶ国・179名の研究者がこの研修プログラムを修了し、母国に帰って原虫感染症対策で中心的な役割を果たすとともに、国際共同研究のカウンターパートとしても活躍してくれています」
2008年には、家畜の健康や畜産品の安全・安心を司る国際機関OIE(国際獣疫事務局)から、アジアで初めて「コラボレーティングセンター」に認定された。動物の感染症診断技術や家畜衛生の向上への貢献が期待される、最先端の研究組織だけが受けられる認定だ。

西川教授が原虫感染症の研究に取り組み始めたのは、「ワクチンをつくりたい」という強い動機があったからだ。中学生のころ、天然痘のワクチンを開発したエドワード・ジェンナー(英国:1749-1823)の伝記を読んで感動したのがそのきっかけだと西川教授は当時を振り返る。
「ジェンナーのようにワクチンをつくり、病気で苦しむ人をひとりでも減らしたい。その思いを胸に抱き、生命科学の研究を始めました。大学院の修士課程まではウイルス感染症の研究をしていましたが、博士課程に進学するタイミングで指導教官が当センターに移られ、原虫感染症のことを教わりました。原虫感染症は、ウイルス感染症と比べて研究が進んでいない。広く知られてはいないものの、被害も多い。未知の分野に光を当てていけるのが、サイエンスとして純粋に面白そうだと感じましたし、診断法や治療法、ワクチンなど、研究成果を社会に展開していける可能性もある。やりがいを感じて、博士課程から原虫感染症の研究に取り組み始めました」
それから20年近く、その夢は少しずつ具体的な形を帯び始めている。原虫感染症のワクチンが、世界中の多くのヒトや家畜の健康を守ることになる日も、そう遠くはないのかもしれない。


国内で唯一の原虫病に特化した研究拠点。国内外の大学、関連省庁ならびに国際機関との連携を通じてヒトと家畜の原虫病の制圧に向けた先端研究を推進する。それにより、人類の健康と福祉に寄与するとともに、地球規模の課題である食料安全保障に学術貢献することを目的としている。前身組織である原虫病分子免疫研究センターは、1990年に学内共同利用施設として設立。2000年には全国共同利用施設として、2009年には共同利用・共同研究拠点として文部科学省の認定を受ける。
【取材・文:萱原正嗣 撮影:兼成純一】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png