
生物が生きている間も、個々の細胞は“生”と“死”を絶えず繰り返している。
東京医科歯科大学難治疾患研究所の清水重臣教授は、細胞の“死”(細胞死)に着目し、生命の神秘に迫る。細胞の“死”が個体の“生”を支え、“生”を司る細胞機構が細胞の“死”を誘導する。生命の原理は、かくも奇妙なパラドックスによって成り立っている。

研究室で学生と談笑する清水教授。研究者たちの不断の取り組みが、最先端を切り拓いていく。
ヒトは、37兆個ほどの細胞でできている。ヒトが生きている間、新たな細胞が生まれる一方、それと同じぐらいの数の細胞が生体内で死を迎える。生体はこのようにして絶えず新陳代謝を繰り返し、一年のうちに95%もの細胞が入れ替わっているとされる。
細胞の死(以下、細胞死)は、そのプロセスや形態から大きく2つに分けることができる。死が予め遺伝子に組み込まれ、細胞が自ら能動的に死にゆく「プログラム細胞死」と、外的損傷などの要因で受動的に死に至る「ネクローシス(壊死)」である。前者は主に細胞全体が萎縮・断片化し、後者は主に細胞が膨張・破裂するという形態的な特徴がある。
東京医科歯科大学の清水重臣教授は、細胞死の研究に長く取り組んでいる。この分野で世界に先駆けて新たな発見を続け、論文は英国科学誌『Nature』やライフサイエンス分野の最重要学術誌『Cell』などで幾度も取り上げられた。
「プログラム細胞死は、生物が生きていくために不可欠な仕組みです。なかでも最もよく研究されているのが、1972年に報告された『アポトーシス』で、生物個体の発生と分化の過程でよく見られます。代表例は神経細胞や指の発生です。胎児は母体内で生物の進化を辿ると言われ、ある時期の胎児の指と指の間にはカエルのように大きな水かきがありますが、アポトーシスの働きによって失われます。また、さまざまな要因で遺伝子がダメージを受けた場合もプログラム細胞死が発動します。これには、傷ついた遺伝子から異常なタンパク質が合成され、生体に不具合が出るのを防ぐ意義があります」
このように、生物個体の“生”は細胞の能動的な“死”によって支えられている。つまり、このプログラムに異常が発生すると、個体の“生”にもさまざまな影響が及ぶ。
そのため、細胞死とがんや神経疾患などの疾患との関連が、世界中で盛んに研究されている。清水教授もその一人であり、細胞死のメカニズムを解明する基礎研究を土台に、創薬を目指した応用研究も手掛けている。
ここから先は、教授の研究の足跡を振り返りながら、“生”と“死”が織りなすドラマと、研究の最前線に迫っていきたい。
清水教授が細胞死の研究に取り組み始めたきっかけは臓器移植だ。1984(昭和59)年に大阪大学医学部を卒業し、消化器外科医として臓器移植の研究を手掛けていた。
当時の日本では、角膜や腎臓の移植は認められていたものの、その他の臓器は移植の対象外だった。心臓や肝臓など広く臓器全般の移植を認める法律ができたのは1997(平成11)年のことだ。
「その間にも欧米では移植手術が行われていて、日本の医師たちも来るべき日に備え、臓器移植の成功率を高める研究に取り組んでいました。臓器移植の成否を分けるポイントは大きく2つあります。ひとつは、臓器提供を受ける患者の免疫による拒絶反応をいかに防ぐか。もうひとつは、ドナーから臓器を取り出したあと、臓器の傷みをどのようにして防ぐかです。私たちは後者のポイントに着目して研究を行っていました」
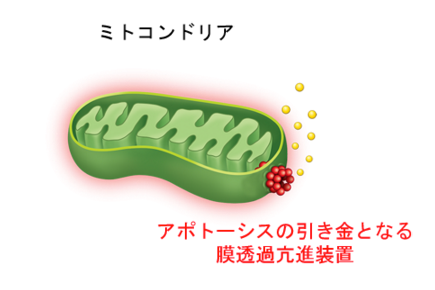
ミトコンドリアのイメージ図。ミトコンドリアがアポトーシスの誘導シグナルを受け取ると、外膜の透過性が増し、外膜と内膜にあるタンパク質(図中で黄色く示した)が外膜の外側に漏れ出してくる。
清水教授(当時は大阪大学医学部旧第一外科所属の臨床医)らは、細胞内小器官(オルガネラ)のひとつである「ミトコンドリア」に注目した。ミトコンドリアは、血液が運んできた酸素を受け取り、生体内のエネルギー物質をつくり出す重要なオルガネラである。
「臓器に血液が流れなくなると、酸素や栄養が行き届かなくなり、細胞はダメージを受けます。細胞内で最初にダメージを受けるのは、酸素を受け取るミトコンドリアだろうと推測しました。血液供給が途絶える時間が長くなると、細胞は死んでいきます。臓器を取り出した後、細胞がどのようにして死んでいくのか。ミトコンドリアの変化に着目して研究に取り組みました。結果は予想どおり、ミトコンドリアの変調が細胞死の重要な引き金になっていることが分かってきました」

細胞の培養液をつくる研究室の学生。細胞死の研究にとって、細胞培養は不可欠なプロセスであり技術だ。
1994年、清水教授は大阪大学医学部第一生理学教室に籍を移し(当時の肩書は助手)、細胞死とミトコンドリアの関係を探る研究に本格的に取り組み始めた。そのころ世界ではアポトーシスの研究が盛んに行われており、清水教授もアポトーシスの研究に力を注いだ。
「当時、アポトーシスが起こる分子生物学的なメカニズムについてはまったく分かっていませんでした。ここでも私たちはミトコンドリアに着目し、アポトーシスの誘導にミトコンドリアがきわめて重要な働きをしていることを突き止めました。ミトコンドリアは、外膜と内膜という二重膜を持ちます(上図参照)。ミトコンドリアがアポトーシスを誘導するシグナルを受け取ると、外膜の透過性が増し、外膜と内膜の間にあるタンパク質が外膜の外側、つまり細胞質に漏れ出します。そのタンパク質が、アポトーシスを進行させるのです」
生体の“生”に欠かせないミトコンドリアが、細胞の“死”を司っている。一連の研究成果は、1995年と1999年の『Nature』や2003年の『Cell』などで発表された。
なお、臓器移植における細胞死は、アポトーシスではなくネクローシス(壊死)に該当する。清水教授らは、このときの細胞死でもミトコンドリアの二重膜の変化が重要な引き金となっていることを突き止めた。この論文は、2005年に『Nature』に掲載された。
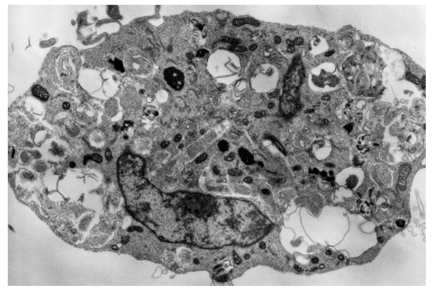
アポトーシス耐性細胞に外的ストレスとして抗がん剤を投与し,18時間後の電子顕微鏡像。細胞内に大量のオートファゴソーム(下記参照)形成がみられる。
2000年代に入ると、清水教授の研究テーマにもうひとつの柱が加わった(当時の肩書は大阪大学医学部遺伝子学教室助教授)。
「2002年に欧米の研究グループが、アポトーシスの起きない遺伝子改変マウスをつくり出しました。アポトーシスの誘導に不可欠な遺伝子を持たないマウスです。そのマウスの細胞にさまざまなストレスを与えたところ、アポトーシスとは異なる細胞死が起こることを発見しました。それが、オートファジー(自食作用)による細胞死です。『オートファジー細胞死』は、何らかの理由でアポトーシスが誘導しない場合、その代わりに発動されるバックアップ機能と考えています」
世界に先駆けた発見だった。成果をまとめた論文は、2004年に『Nature Cell Biology』に掲載された。
「オートファジー(autophagy)」とは、細胞内で不要になった自己成分を細胞自ら除去する機能のことだ。「auto-」はギリシャ語で「自分自身」を表す接頭辞、「phagy」は「食べること」を意味し、日本語では「自食作用」とも呼ばれる。原始的な酵母から私たちヒトまで、細胞内に核を持つ真核生物がこの機能を普遍的に備えている。細胞の恒常性や健全性を保つ役割を果たしていると考えられている。
オートファジーの概念が最初に提唱されたのは、今から半世紀以上前の1963年にまで遡る。だが、その生物学的意義やメカニズムの解明は長く進展が見られなかった。その停滞を打破したのが、東京工業大学名誉教授で2016年にノーベル生理学・医学賞を受賞した大隅良典博士である。1990年代に酵母(出芽酵母、Saccharomyces cerevisiae)を使ったオートファジー研究に着手し、オートファジーに関わる遺伝子やタンパク質の多くを発見した。
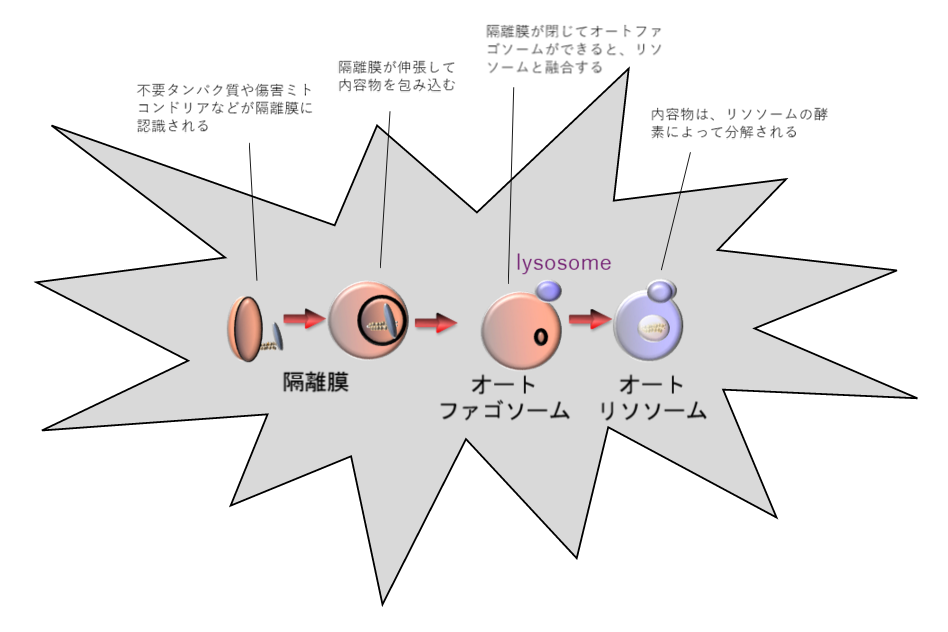
オートファジーのメカニズムの模式図。不要になったタンパク質や傷害ミトコンドリアが膜(隔離膜)に包まれとオートファゴソームが形成される。オートファゴソームはリソソーム(lysosome)と融合し、リソソームの酵素によって内容物が分解される。

蛍光顕微鏡で細胞の状態を見る研究支援員。細胞死やオートファジーの研究には、光学顕微鏡や電子顕微鏡が不可欠だ。
オートファジーのメカニズムはおおむね次のとおりだ。
まず、細胞内で「オートファゴソーム」と呼ばれる膜が形成され、細胞内のさまざまな成分を包み込む。この膜がリソソームと呼ばれる細胞内小器官(オルガネラ)と融合し、リソソームの消化酵素の働きによって、膜内に取り込まれた物質が分解される。分解対象の物質は、タンパク質やDNAなど多岐にわたり、タンパク質から分解されたアミノ酸は、再利用されてタンパク質の再合成に使われる。
「平常時、細胞内でオートファジーは軽度に誘導されています。細胞構成成分を少しずつ分解し、細胞の新陳代謝に寄与しているのです。また、細胞が飢餓状態に陥ったときはオートファジーが顕著に活性化され、細胞質中に多くのオートファゴソームが形成されます。生存に不可欠な生体反応を維持するべく、自身の生体成分を分解して生き延びるためです。オートファジーが正常に働かない細胞は早期に死に至ることが確認されており、オートファジーは細胞の“生”に貢献する重要な細胞機能です」
なお、オートファゴソームの確認には電子顕微鏡が必要だ。この確認の困難さが、オートファジー研究が長く停滞した要因のひとつである。
清水教授らが発見した「オートファジー細胞死」とは、細胞の“生”に貢献するオートファジーが原因となって起こる細胞死のことだ。以前から、死んだ細胞のなかにはオートファゴソームが多く存在しているものがあり、見掛け上もアポトーシスとは違いがあることが確認されていた。だが、オートファジーと細胞死との関連は未解明のままだった。
「アポトーシスが起きない細胞にさまざまなストレスを加えると、多くのオートファゴソームが形成され、細胞内に充満して細胞が死に至りました」と清水教授は当時を振り返る。以来、オートファジーも主要な研究テーマとなった。
オートファジー研究でも、清水教授らによる「世界初の発見」があった。
大隅博士らの功績により、オートファジーには複数の主要な分子が関わっていることが明らかにされている。なかでも特に、Atg5と呼ばれるタンパク質はオートファジーに必須と考えられいた。清水教授らはその“常識”を覆す発見をしたのだ。
「私たちがAtg5遺伝子を持たないマウスの細胞にさまざまなストレスを与えたところ、通常のマウスの細胞と同じく、オートファジーが大規模に起きていることが確認できました。特に顕著だったのがDNAを損傷させるストレスを加えたときです。DNAが損傷すると、損傷したDNAの情報にもとづいて誤ったタンパク質が合成されます。それにより細胞内で異常が起こることを防ぐため、オートファジーが誘導されたと考えられます」
清水教授らは、Atg5タンパク質を必要としないこのオートファジーを「新規オートファジー(alternative macroautophagy)」と名付け、論文は2009年に『Nature』に掲載された。
清水教授らは、従来型のオートファジーと新規オートファジーの両方が、酵母からヒトに至るまで真核細胞に備わっていることも確認した。
「興味深いことに、細胞がふたつのオートファジーを使い分けているらしいということも分かってきました。その典型例は、赤血球の分化過程で見ることができます。赤血球細胞は、核とミトコンドリアを持たない特殊な形態をしています。赤血球のミトコンドリア除去には、Atg5に依存しない新規オートファジーが関わっていることを私たちの研究で突き止めました」

清水教授の穏やかな語り口のなかにも、細胞死やオートファジー研究の新たな道を切り拓いた自信が感じられた。
なぜ、清水教授らは新規オートファジーを発見することができたのか。言葉を換えれば、なぜ他の研究グループはこの機構を発見することができなかったのか――。理由を尋ねると、次のような答えが返ってきた。
「私の研究のバックグラウンドに細胞死があったからだと思います。大隅先生は、オートファジーの研究を栄養飢餓ストレスに対する細胞の反応を調べる形で進めてこられました。そのため、その後もオートファジー研究と言えば、栄養飢餓への反応を調べることが中心でした。私たちは、細胞死の観点からオートファジーを調べていたため、新たな機構の存在に気づくことができたと思っています」
新たな発見は、新たな視点から導かれたのである。
そして今、清水教授らは、細胞死やオートファジーの基礎研究に加え、薬剤開発を目指した応用研究にも力を入れて取り組んでいる。細胞死やオートファジーは、これまで見てきたように、細胞の恒常性や健全性を維持するための機構だ。がんや神経疾患などのさまざまな病気で、細胞死やオートファジーの機構の不全が確認されている。
「がんとの関わりで言えば、アポトーシスの変調が発がんに関わることが確認されています。そのため、既存の抗がん剤の多くは、がん細胞にアポトーシスを誘導して抗がん作用の発揮を狙ってつくられています。ただ、抗がん剤がすべてのがんに有効なわけではありません。また、卵巣がんや乳がん、前立腺がんなどでは、オートファジー細胞死の発現量が低下していることも確認されています。オートファジー細胞死を活性化する化合物が、新たながん治療薬になりうると考えています」
神経疾患に対しても、カギを握るのはオートファジーだ。
「オートファジーは、細胞内の不要な物質を分解するための仕組みです。神経細胞でオートファジーの不全が起こると細胞内に不要な物質がたまり、それが神経疾患の要因になります。タウという物質の蓄積はアルツハイマー病を、ポリグルタミンの蓄積はハンチントン舞踏病を誘発します。オートファジーを活性化する化合物は、これらの疾患に対する治療薬になりえます」
清水教授らは、これらの疾患に有効な化合物の探索に取り組んでいる。また、創薬研究を加速させるため、電子顕微鏡を使わずにオートファジーの発現を目視できる技術も開発し、特許を取得した。
臨床医から始まった歩みは、基礎研究の蓄積を経て、薬剤開発という道に辿り着いた。アプローチは変わっても、清水教授は人の命と向き合い続けている。


(写真:研究所提供)
「難治疾患の学理と応用」を目的とした、“難治疾患”を標榜するわが国唯一の国立大学法人附置研究所。1973年、医学部附属の7つの研究施設の再編によって設置された。英語名の“Medical Research Institute”が示すように、難治疾患発症の学理を、基礎医学・生物学研究から理解することを目指している。先端分子医学研究部門・難治病態研究部門・ゲノム応用医学研究部門の3部門、22分野からなり、基礎から応用までを幅広くカバーする。
【取材・文:萱原正嗣 撮影:カケマコト】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png