

あらゆる生物は、遺伝子に支配されている。遺伝子の目的は自分のコピーをつくる、すなわち遺伝情報に定められたとおりの細胞を複製することだ。ところが遺伝情報の伝達過程で不具合が生じると、本来とは異なる細胞が作られ病気となる。大阪大学産業科学研究所の中谷和彦教授は、誤った遺伝情報への着目によって未知の物質を発見し、不治の病である遺伝子疾患の治療可能性を見出した。
「DNA(デオキシリボ核酸)」や「遺伝子」「ゲノム」などの用語をよく目にするようになった。DNAとはA(アデニン)・T(チミン)・C(シトシン)・G(グアニン)の4種の塩基が鎖のように連なってできた物質である。その鎖はAとT、CとGがそれぞれ対(塩基対)をなし、二重らせんの構造体を形作る。これは20世紀生命科学における最大の発見とされ、発見者のジェームズ・ワトソンとフランシス・クリックはノーベル生理学・医学賞を受賞した(発見は1953年、ノーベル賞受賞は1962年)。
ヒトの細胞には、核の中に23対の染色体が存在する。DNAは、染色体に含まれる主要なパーツだ。ヒトのDNAは約30億の塩基対で構成され、塩基の連なりは「情報」として意味を持つ。その情報としてのまとまりが「遺伝子」であり、ひとつの遺伝子からはひとつのタンパク質がつくられると、昔は考えられていた。タンパク質は生命活動において重要な役割を果たしており、それゆえDNAは「生命の設計図」とたとえられる。ヒトはおよそ2万2,000の遺伝子を持つ。
だが、約30億の塩基がすべて遺伝子として機能するわけではないことが近年明らかになっている。遺伝子として意味を持つのは、DNAの全塩基配列のうちの約3%に過ぎない。残りの97%は、かつては意味のないゴミだと思われていたが、さまざまな機能を持つことが明らかにされつつある。遺伝子領域だけではない、ある生物が持つ全塩基配列のことを「ゲノム」という。
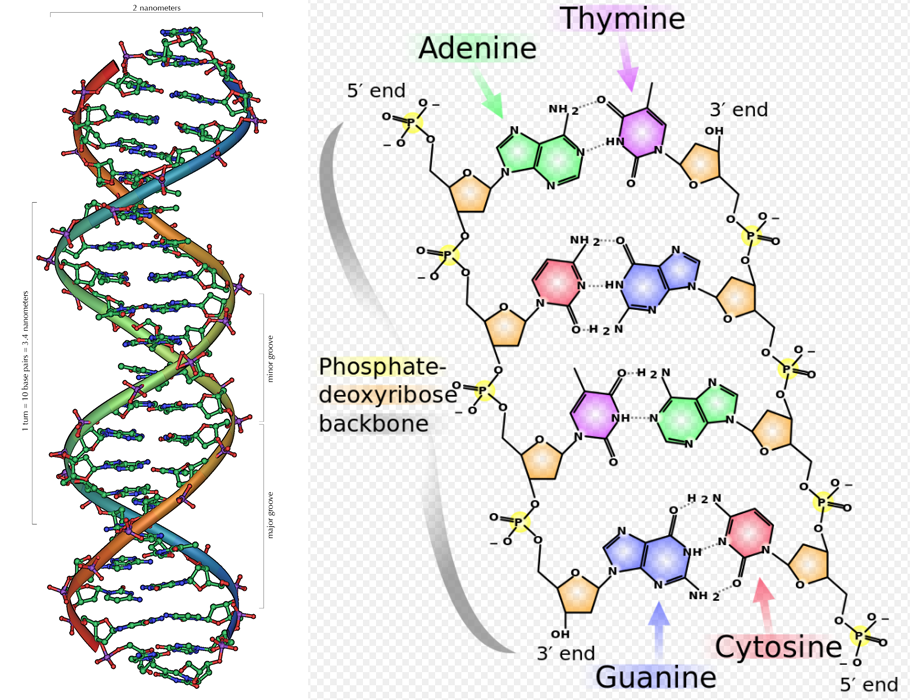
左の図が表すのは、DNAの二重らせん構造である。右図にはアデニン(Adenine)とチミン(Thymine)、グアニン(Guanine)とシトシン(Cytosine)がそれぞれ結合する様子が示されている。左図:Created by Michael Ströck. 右図:Created by Madeleine Price Ball
細胞が分裂して増殖する際、DNAも複製される。そのときはかなり複雑なことが起きている。
「DNAは、A-T、G-Cの塩基対で構成されています。これを『ワトソン-クリック塩基対』と言います。けれどもA、T、C、Gと4種類の塩基の組み合わせを単純に考えるなら、G-G、G-A、G-T、C-C、C-A、C-T、A-A、T-Tとほかにも8種類の対がありえます。実際DNAはこうした誤った塩基対を形成することがあり、これを“ミスマッチ塩基対”と呼びます。DNAが複製される過程でのエラーや塩基の損傷などにより、このミスマッチは頻繁に発生しています」
ミスマッチ塩基対を放置しておくと、遺伝子配列が本来のものから変わってしまうリスクがある。そうしたトラブルを防ぐため、ミスマッチ塩基対ができるとただちに取り除く仕組みが細胞には備わっている。そのため、普通DNAには、ミスマッチ塩基対がほとんど存在しない。だが、何らかの理由によってミスマッチ塩基対ができてしまうと、異常つまり病気が引き起こされてしまうのだ。
中谷教授は、30年近く前からこのミスマッチ塩基対に注目してきた。当初の研究テーマは、ミスマッチ塩基対の位置特定である。たとえばC-G対の代わりに、G-G対ができている場所があるなら、その位置を見つける。
C-G対やA-T対は本来のワトソン-クリック塩基対であり、強く結合している。これに対してG-Gなどのミスマッチ塩基対は、結合力が弱い。であるなら、仮にG-G対を構成する2つのGに対して、相方のGよりも強く結合する有機分子を作って結合させれば、ミスマッチが起こっている部分を特定できる。これが、中谷教授が考案した「ミスマッチ結合認識分子」の基本的な考え方だ。
「考え方はシンプルで、結合させる分子も低分子で事足ります。それなら簡単につくれると思えたのですが、実際には大違いでした。ミスマッチ塩基対はワトソン-クリック塩基対に比べて安定性が低く、常に構造がゆらいでいます。構造のゆらぎとは、分子構造が常に変化している状態を意味します。『ミスマッチ結合認識分子』を設計しようにも、その指標が存在しない状況でした」
結合させる相手の構造が固定されていれば、それに合う物質の設計は理詰めで決められる。けれども、常に形を変え続ける相手にぴったりはまる物質を、どのように設計すればよいのか。
中谷教授はコンピュータを駆使し、ミスマッチ塩基対とそれに結合する分子がお互いに変化する状況を、片っ端からシミュレーションする戦略を採った。といえば、昨今では特に目新しい手法ではないが、今からざっと四半世紀近くも前、教授がまだ京都大学工学部で助手を務めていた90年代となると話は違ってくる。この当時、そこまで大規模な演算をこなせるほどの高性能コンピュータはごく限られていた。
「幸いにもそのとき私の研究室には、Silicon Graphics社製のINDYワークステーションがありました。高性能で高価な計算機を自由に使える環境にあったからこそ可能となった研究手法です」
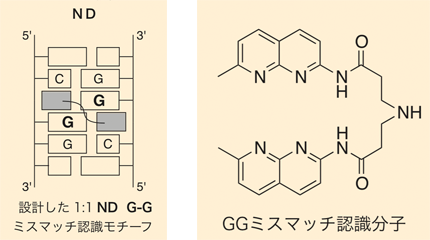
左図:G-Gというミスマッチ塩基対にミスマッチ認識分子NDが結合する様子。
右図:G-Gミスマッチ認識分子ND(ナフチリジンダイマー)、分子式はC24H25N7O2で表される。
シミュレーションを繰り返すなかで開発されたのが、G-Gミスマッチ塩基対に結合する、世界初の人工ミスマッチ認識分子「ナフチリジンダイマー(ND)」である。この発見を記した論文は、『Nature Biotechnology』誌に掲載された。一つ突破口が開かれると、芋づる式に次の成果が出てきた。ただし、2002年の時点では、これらミスマッチ認識分子が、最終的にどのような役に立つのかはまだわかっていなかった。
「トリプレットリピート病」と呼ばれる遺伝性の神経変性疾患がある。症状により病名が異なる。舞踏運動などの不随意運動や行動異常、認知障害を伴う場合はハンチントン病、X染色体の異常により精神発達障害や情緒不安定、多動症などを起こすと脆弱X症症候群、筋強直や筋弛緩など起こす場合には筋緊張性ジストロフィーと診断される。いずれも遺伝子配列に特定の異常が起こるために発症する病気である。
人の遺伝子には、特定の3つの塩基が繰り返される配列「トリプレットリピート」がある。このトリプレットリピートが異常に長く繰り返されてしまった結果、発症するのがトリプレットリピート病である。「CAG」が伸びるとハンチントン病、「CGG」なら脆弱X症候群、「CTG」は筋緊張性ジストロフィーをそれぞれ引き起こす。
なぜ、こうした異常が起こるのか。生まれ持った遺伝子に異常があり、DNAに本来備わっているはずの、遺伝子の異常を感知し修復する機能が働かないためだ。このような遺伝子疾患は今のところ治療不可能であり、根本的な治療法はもとより進行を抑える術もない。
ところが、ミスマッチ認識分子の活用により、不治の病である遺伝子疾患トリプレットリピート病の治療可能性が出てきた。
「トリプレットリピート配列に特異的に結合する低分子化合物『ナフチリジン-アザキノロン(NA)』を開発しました。このNAを使った化学センサーで『CAG』のリピート回数を計測し、その数値に基づいてハンチントン病を正確に診断できるようになりました。いま取り組んでいるのが、NAや新たに開発したミスマッチ認識分子『ナフチリジン-カルバメートダイマー(NCD)』を使った疾患の機構解明です。疾患が起こる機序を解明できれば、トリプレットリピート伸長をこれらの低分子化合物で調節して、病気を治せる可能性が出てきます」

遺伝子疾患とは、生まれつき遺伝子に異常があるために引き起こされる疾患であり、これまでその治療法は存在しなかった。そうした病に苦しむ人を助けたいというのが、研究にかける中谷教授の強い思いだ。
2013年には、中谷教授らの研究成果であるデータと化合物を使った大阪大学医学部との共同研究がスタートした。動物実験では成果も出ている。教授らが開発した分子を、ハンチントン病のモデルマウスの脳に打ち込むと、異常に伸びたトリプレットリピートが短くなったのだ。
遺伝子疾患は、その人の遺伝子が変わらない限り治らない病、つまり不治の病であった。逆にいえば、遺伝子を変えることができれば、遺伝子疾患にも治療の可能性が出てくる。中谷教授らが開発した低分子化合物が、異常に伸びたトリプレットリピート配列を短くする効力を持つと実証されれば、遺伝子疾患に苦しむ人たちには大いなる福音となるはずだ。
「トリプレットリピート病」は、特定の3塩基が異常に長く繰り返される結果、病気を発症する。これに対して遺伝子には、特定部分の塩基配列が一定値より短くなると、細胞死を引き起こす機能も備わっている。この機能に関与する部分が「テロメアリピート」と呼ばれる、ヒトのDNAの末端部分にある特定の塩基配列である。
テロメアリピート配列(TTAGGG)は、細胞分裂を繰り返すたびに短くなっていき、特定の長さより短くなったときに細胞の寿命が尽きる。つまりテロメアリピート配列は、細胞の寿命を決めるタイマーとして機能しているのだ。
「ヒトの細胞を適切な条件で培養すると、しばらくの間は増殖を続けますが、増殖が一定回数を超えると、それ以上は増殖しなくなります。これはテロメアリピートが短くなり、細胞の増殖を止めるよう生体時計が指示するからです。がん細胞が異常に増殖を繰り返すメカニズムにも、このテロメアリピートが関係しています。がん細胞では通常の細胞と異なり、短くなったテロメアリピートが再び長くなる異常なメカニズムが機能しているのです。従って、がん細胞特有の再伸長メカニズムを阻害できれば、がん治療への応用可能性が出てきます」
中谷教授らのグループは、がん細胞のテロメアリピートがつくる構造にG-Gミスマッチ塩基対が多数含まれる点に着目した。G-Gミスマッチ認識分子であるNDやナフチリジンテトラマー(NT)を試してみると、がん細胞のテロメアリピートに結合した。すなわち、NTなどのミスマッチ認識分子は、テロメア伸長を阻害する薬剤、つまり革新的ながん治療薬となりうるのだ。

中谷教授の研究室にあるホワイトボード。教授の頭の中には常に、DNAとこれに結合する分子の構造が浮かんでいるようだ。
医学の進歩により、ミスマッチ塩基対を正確に認識する効用がほかにも出てきた。次世代医療とされる「個別化治療」での活用である。ミスマッチ塩基対の認識は、個別化治療を実現する上で必須の技術となる。
何らかの病気が、遺伝子のどこかでミスマッチ塩基対が発生した結果として発症しているとすれば、その病気を治療するには、ミスマッチ塩基対が発生している場所を正確に突き止める必要がある。
遺伝子の異常を検査する装置としては、「DNAマイクロアレイ」が知られる。多数のDNA断片をプラスチックやガラスなどの基板の上に高密度に配置し、一斉に検査することができる。だが、これは大がかりな装置であり、検査センターなどでの大規模な遺伝子解析には適しているものの、病院など医療現場での使用には適さない。
「ミスマッチ結合分子を金膜表面に固定し、遺伝子変異を検出するミスマッチ検出センサーやミスマッチ分離クロマトグラフィーの開発を目指しています。これらの検査機器はコンパクトで扱いやすくなるため、個別化医療に欠かせない遺伝子解析を迅速かつ簡便に、しかも安価で実現できます」
中谷教授らが開発に取り組んでいるミスマッチ検出センサーは、これから本格化する個別化医療に必須のツールとして機能するはずだ。
ミスマッチ塩基対では、塩基が常に構造を変化させている。変化する塩基に結合する分子を設計するために、若き日の中谷教授が採用したのが、コンピュータシミュレーションだ。それから30年が経ち、コンピュータパワーは、当時とは比べ物にならないぐらい強力になった。こうした環境の変化を追い風として、中谷教授がいま取り組んでいるのが、計算科学と精密実験の融合によるミスマッチ塩基対結合分子の理論的解明である。
「ミスマッチ塩基対に低分子が結合する際の原子と電子の振る舞いを、量子化学の理論にもとづいて計算します。計算結果を実験で確かめられれば、計算によるシミュレーションが間違っていなかった証明となります。さらにSPring-8にある『X線自由電子レーザー施設SACLA』を使い、ミスマッチ塩基対の結晶に他の分子が結合していくプロセスを視覚的に確かめることも視野に入れています」

ミスマッチ塩基対の実験に勤しむ大学院生、見守る中谷教授の眼差しはやさしさに満ちている。日本でも数えるほどしかいないミスマッチ塩基対の研究にも、ようやくその後継者が現れてきた。
もうひとつ、教授が期待するのがAI(人工知能)の活用だ。現時点ではまだ具体的な活用法は見えていないが、機械学習の精度が量子化学計算の計算精度が実験結果を予測できるレベルまで高まってきた。計算に必要なソフトやハードなどの計算資源も整いつつある。ビッグデータの解析も含めてAIは、今後研究を進める上での大きな力になると期待されている。
「今や修士の学生が、僕には想像もできなかった膨大な計算を、何食わぬ顔でやってしまい、その成果を見せてくれるような時代です。難解なミスマッチ塩基対に関しても、若い人たちが興味を持ってくれるような環境がようやく整ってきました」
ミスマッチ塩基対を専門とする化学研究者は、日本で10人に満たない。ミスマッチ塩基対とは、それほど難解な研究対象である。難易度の高い研究に30年以上も中谷教授が関わり続けた理由は、純粋に「興味があったから」だという。
「研究を始めたのは、京都大学工学研究科で齋藤烈先生の研究室に助手として入ったときからです。准教授(当時は助教授)に杉山弘先生というワトソン-クリック塩基対に結合する分子の研究では世界的な第一人者がおられました。DNAの研究をやるにしても、杉山さんと同じ領域では勝ち目がない。しかも齋藤先生からは、人と違う研究、これまで誰もやったことのないテーマを強く求められました。失敗しても構わないから、とにかく新しいことをやれ。そう指示、というか激励下さったので、ミスマッチ塩基対に取り組んだのです。2003年にヒトゲノムが解析される前の話です」

産業科学研究所の玄関を入ったところに展示されている巨大な分子構造模型。研究に疲れたときには、この複雑な構造を見るともなく眺めることが気分転換になる。
中谷教授がいま、後に続く世代のための重要なテーマと捉えているのが、RNAに結合する分子の開発だ。ヒトゲノムの機能を調べた結果、DNAからRNA、RNAからタンパク質が合成され、タンパク質が機能を発揮するという『セントラルドグマ』の考え方は、随分変わった。ヒトゲノムのうちタンパク質になる部分は3%、使われない部分、つまりDNAから変わらないところが20%、残りの76%は、RNAで機能を発揮することが分かっている。
RNAに転写されないDNAが20%も残るのには、何か特有の働きがあるためと考えられているが、その機能はまだ何も解明されていない。さらにタンパク質に翻訳されないRNAが76%もある。このRNAからは生命活動を調節する機能が相次いで見つかっている。そのためRNAは、次世代創薬のターゲットとして製薬企業が取り組み始めている。
「ただ、これまでのところRNAに結合する分子の開発については、具体的な方法論さえ定まっていません。仮に画期的な研究方法を見つけられれば、この先少なくとも10年間は、この分野をリードしていけるでしょう。もちろん、ノーベル賞の可能性もあります。そんな分野に、若い研究者の興味を向けさせたい。誰もやっていない研究、だからこそ難しくもあり、何か成果を得られれば、その喜びはこれ以上ないものになります。その喜びを何とかして伝えたい」
世界中の研究者がしのぎを削る生命科学の世界で、次世代を担う世界的な研究者を育成する。これがいまの中谷教授にとって喫緊かつ最重要のテーマである。


自然科学に関する特殊事項で産業に必要なものの基礎的学理及びその応用の研究を目的として、1939年に大阪産業界の支援を受けて設立された。現在は、材料・情報・生体の3つの領域での研究とナノテクノロジー分野の研究で、国内外に例のない最先端の研究を推進し、環境・エネルギー・医療・安全安心の課題解決に向けた社会貢献を目指している。
【取材・文:竹林篤実 撮影:大島拓也】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png