

日本のテクノロジーの象徴であった半導体技術。広島大学ではその長年の知見を応用しながら医療分野と融合することで新たな「生体医歯工学」という学術領域を開拓し、産業化へとつながる道を探求している。同研究所で行われている多くの研究の中でも、近い将来、臨床への応用が期待されるのが「半導体を用いた乳ガンの検査装置」だ。その開発を進める吉川公麿所長にお話を伺った。

電波による乳がんの検査技術について解説する吉川公麿教授。「医療の発展には工学の力が大きく寄与できる」と語る。
日本人女性が発病するがんの中で、最も多いのが乳がんだ。2015年の国立がん研究センターの調査によれば、生涯に乳がんにかかる日本人女性は12人に1人になる。また厚生労働省の発表では2015年に13,000人以上の女性が乳がんのために亡くなっているが、これは1980年に比べて約3倍の死亡者数だ。
増加の原因の一つと考えられるのが、日本人女性の乳がん検診率の低さである。欧米では近年、乳がん検診の受診率の高まりと反比例して死亡者数が年々低下しているが、日本の乳がん検診率はOECD(経済協力開発機構)加盟30カ国の中で最低レベルにある。

現在、同研究所の所長を勤める吉川氏は、日本電気(NEC)の研究所で長年にわたり半導体の研究を行った後に、広島大学へと赴任した。
日本で女性を乳がん検診から遠ざけている要因が、現在の乳がん検診の主力検査機器「X線マンモグラフィ(乳房撮影装置)」だ。
X線マンモグラフィは装置が大型で、高価であることから、主に大学病院などの大規模病院に設置されている。そのため地方や過疎地に住んでいる女性が、地元の小さな医院やクリニックで気軽に検査を受けることは難しい。またマンモグラフィはX線という電離放射線を照射するため、微量であっても検査時に被曝することが避けられない。検査ではできるだけ被曝量を少なくし、乳腺組織を広げて見やすくするために、乳房をプレートではさみ、2〜5センチの厚さに薄く引き伸ばす。そのため乳がん検査は痛みを伴う。
乳がんの検査手法には他にも、PET(陽電子放射断層撮影)やCT(コンピュータ断層撮影)があるが、強い放射線を使うため、国が定める年間被曝量の基準を超えないように年1回しかできない。進行の早い乳がんは早期発見が治療の鍵を握るため、できるだけ侵襲性が低く、高頻度で受けられる検査手法が望ましい。
そこで新しい乳がんの検査手法として、広島大学のナノデバイス・バイオ融合科学研究所、所長の吉川公麿教授が開発を進めるのが、「半導体を使った電波による乳がんの検出技術」だ。
吉川教授は正常な細胞と腫瘍細胞を見極める指標として、細胞が作る組織の「誘電率(電気をためる性質)」と「導電率(電気を通す性質)」に着目した。乳がんが発生する場所は、乳房を形作る組織のうち乳腺の「間質」と呼ばれる部分だ。乳がんを発症すると間質の細胞が腫瘍細胞に変わり、その場所は血液や水分などが通常より多く必要になると考えられる。それに伴い誘電率・導電率ともに正常組織より高くなることから、乳房に電波を照射して、誘電率の異なる腫瘍界面で反射した電波の飛行時間を解析することで、腫瘍組織の位置を表示することが可能となる。電波を対象に向けて放射し、その反射を解析するという原理は、飛行場の管制塔や船舶などに搭載されている「レーダー」と同じ仕組みだ。
「ただし飛行機や船舶を検出するレーダーは、対象とする物体が使用する電波の波長より十分大きく、波長の何百倍以上も離れた場所にあるものを探します。そのため容易に対象物を検出できるのに対して、乳がんの検査機器は波長約3センチの電波で、波長程度の超近接距離にある、波長の5分の1程度の大きさの物体を検出しなければなりません。電波を使って超近接のフィールドを探査する技術は、信号が微弱で解析が非常に難しいことから、これまでレーダーの研究者はほとんど手を付けてこなかった分野です。本装置開発のいちばんの難しさも、そこにありました」
吉川教授が開発した電波による乳がんの検査機器は、電波を送信するアンテナアレイと制御回路、ごく短時間の電波(インパルス)を生成する送信回路、ターゲットで反射して戻ってきた信号を受信しリアルタイムで検出するサンプリング回路の3つで構成される。
アンテナ以外の部分は、コンピュータのLSI(大規模集積回路)などに使われる、CMOS(相補型金属酸化膜半導体)という半導体集積回路でつくられている。
「この装置に使う電波の周波数帯域は3ギガヘルツから10ギガヘルツ、中心周波数は6ギガヘルツで、時間に直すと約160ピコセカンド(1ピコセカンドは1兆分の1秒)です。このような短時間の電波を解析するには、波形を10ピコセカンドの信号でサンプリングする必要がありますが、今の技術では直接10ピコセカンドの短時間の電波をつくるのは極めて困難です」

電波を放射し、反射を受け止める16個のアンテナアレイ。
そこで吉川教授は回路に次のような工夫を施した。高速で動いている物体に、一定間隔でフラッシュを当てると、物体はまるでスローモーションで動いているように見える。その原理を利用して、160ピコセカンドのごく短時間の信号電波を10ナノセカンドの一定間隔(1ナノセカンドは10億分の1秒)で繰り返し送信する。そしてターゲットで反射して帰ってきた電波を10ピコセカンドずつ遅れた信号で順番にサンプリングするとスローモーションのように読み取ることができる。
次に、サンプリングした信号に含まれる飛行時間の情報から、楕円軌道に幾何学的に変換する。そうして16個並べた送受信アンテナのそれぞれの楕円軌道を重ね合わせると、その交点に輝度が最大になる位置が三次元的に表示できる。ここにターゲットの物体(腫瘍)が存在することになる。

広島大学病院の腫瘍外科・病理診断科から提供を受けた35名の乳がん患者の組織を電気的に解析した結果。赤い●が腫瘍組織、青い▲が乳腺間質組織、緑の■が脂肪組織を示している。赤い●と青い▲の距離が離れているほど、組織内のガン細胞の比率が高いことを意味する。
電波を使うことの一番のメリットは、人体への侵襲性が極めて低いことだ。装置に使用する電波は、携帯電話で使われているのと同じ帯域の通信用電波で、出力は携帯電話の1000分の1〜10分の1と非常に微弱であるため、人体に与える影響はほぼゼロと考えられる。
「広島大学の大学病院に入院する、35人の患者さんから摘出した乳がん組織に対して電磁気学的な解析を行ったところ、腫瘍組織と正常組織の誘電率差を定量的に数値化することに成功しました。グラフの赤丸が腫瘍組織、青が乳腺間質組織、緑が脂肪組織を示しています。腫瘍と脂肪組織の誘電率は大きな差があり、腫瘍と間質の誘電率差が大きいサンプルほど、乳腺間質組織中の腫瘍細胞の割合が高いことを意味します」
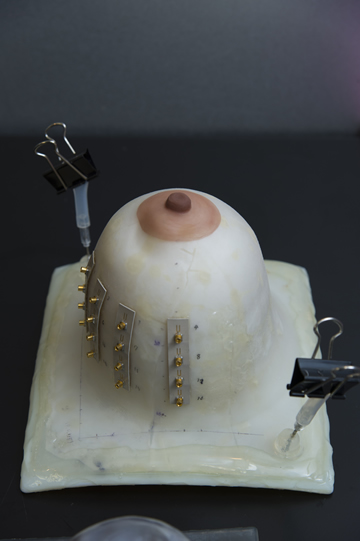
3Dプリンタで作成した実際の乳房を模した試料。
装置開発後の予備実験では、3Dプリンタで作られたプラスチック製の模擬乳房(右の写真参照)に、腫瘍組織に見立てたベーコンを入れ、違いを検出できることを確認した。これまでに吉川教授は、アタッシュケース大のプロトタイプ-2、それを小型化したプロトタイプ-3を製作してきた。今年度からは、広島大学病院の腫瘍外科と協力して、臨床研究を開始する予定だ。
「大学病院の倫理審査委員会で、臨床研究の許可が下りたので、早ければ4月には前臨床の結果が出る予定です。この装置を使って、本当に人体で乳がんが検出できることを実証したいと思っています」
今後の課題は、装置が検出した画像の解像度をできるかぎり上げることだ。現在の装置の解像度は1センチ角ほど。腫瘍組織が5mm〜6mm以下になると検出するのが難しく、医師からは「少なくともX線マンモグラフィと同程度の精度が欲しい」と要望されている。
「解像度を上げるには、信号の波長を短くする必要があります。この技術が確立すれば、将来は乳がんだけでなく、さまざまな検査機器の可能性を開くと考えています。非侵襲の技術であることから、医師からは『手術中に患部を直接目で見ながら、ガン組織などの切除範囲を確定するための支援ツールにできないか』という問い合わせも来ています。近い将来には携帯電話サイズまで小さくできると考えており、そうなれば医師がカバンに入れて持ち運べるようになるでしょう」
痛みをともなわず、女性が自ら定期的に計測し、データを病院に伝送する。それを医師が画像診断できるようになれば、乳がんで亡くなる方の数を大幅に減らせる可能性が高まる。この機器が一般化し、早期検診・早期治療が浸透すれば、国の医療費削減にもつながっていく。さらに、新しい画期的な国産医療機器は、日本の産業競争力にもつながるはずだ。

1986年に設置された日本の大学では最も古く、かつ現役で使用されているスーパークリーンルーム。3段階のクリーン度に分かれる内部には、D-RAMのメモリー用の半導体薄膜を作る装置や、半導体を描画する電子ビーム露光装置などを備え、半導体デバイスの一貫製作をすることが可能となっている。
吉川教授が所長を務める広島大学ナノデバイス・バイオ融合科学研究所の前身は、半導体素子の研究を目的に1986年に設立された「集積化システム研究センター」だ。2008年、このセンターを改組して現在の研究所が設立され、半導体テクノロジー研究のさらなる高度化とともに、新たなミッションが加わった。それが、医療・生命科学とナノデバイスを融合し、新しい学術領域の先端を切り拓くことだ。
2016年には、東京医科歯科大学、東京工業大学、静岡大学とネットワークを構成し「生体医歯工学共同研究拠点」として文部科学大臣に認定された。所属する研究者はナノテクノロジー・システム領域と、生命科学領域に大きく二分されるが、分野を超えて半導体を用いたバイオセンサや新技術を使った内視鏡画像認識など、多様な研究が進められている。
「2008年の設立当時は、研究者同士の学問領域の違いから、共通する『言語』を見つけるのにも苦労しました。我々はバイオに関する知識がないため、例えば実験に際して『ペプチド』と言われても、それがタンパク質を構成する物質の一種であることがわかりませんでした。しかし交流が進んだ今では、お互いの強みを活かした研究が沢山行われるようになり、大腸がんをリアルタイムで画像認識する技術など特筆すべき成果が生まれつつあります」
吉川教授は懐かしそうに、これまで歩んできた道程を振り返る。

中国・天津大学から留学してきた、大学院博士課程学生の宋航さん。天津大学在学中から吉川教授と共同研究を行っており、宋さんも乳ガン検査デバイスの製作や実験を行う。
吉川教授は、1998年に広島大学に赴任する以前、日本電気(NEC)のULSI(超大規模集積回路)デバイス開発研究所で部長を勤める民間の研究者だった。
「日本の半導体研究の第一人者として知られ、86年の創設よりこの研究センターの長を勤めていた廣瀬全孝先生からお誘いをいただき、本学への赴任を決めました。移ってからは経済産業省の『MIRAIプロジェクト』の一環で多層配線技術の研究に5年間取り組み、その成果を産業移管することができました」
80年代中盤に世界シェア50%を誇った日本の半導体産業は、その後、90年代に入ると韓国や台湾の半導体メーカーに追い上げられ、急速に国際競争力を失っていく。2010年代になると国内の半導体メーカーが次々に経営破綻、外国企業に買収される状況となり、日本の半導体は世界市場からすっかり忘れ去られてしまった。
「汎用半導体製品は激烈な価格競争の世界です。日本がかつてそうであったように、製造メーカーは、コストの安い国にシフトしていきます。『だから日本の半導体産業に未来はない』という見方はあまりに短絡的です。日本の半導体産業には、世界最高のポテンシャルを持つ技術者・研究者が大勢います。彼らが持つ無尽蔵とも言える知識や経験を活かし、高い精度と信頼性が求められる医療分野で、新たな市場を創造していくこと。日本が誇る高度な半導体技術を導入することで、低コストかつ信頼性の高い、パーソナル医療機器という新しい市場を切り拓いていくことができるはずです」

クリーンルームで製作した半導体ウェハー。コンパクトディスクやシャボン玉と同様、半導体それ自体には色がないが、超微細な構造のため表面に光の干渉が起こり、角度によってさまざまに光る。
吉川教授が医学の領域に研究の幅を広げたのにはひとつのきっかけがあった。15年程前、吉川教授は肺の病気にかかり、広島大学病院にしばらく入院した。それで吉川教授は自分の病気の治療に関して、内外の医学書を読み、徹底的に調べた。
「医学に目覚めたのはそれがきっかけです(笑)。そのときあるアメリカの医学書を読むなかで、今ではどの医院でも使われている、指先を挟んで血液中の動脈血酸素飽和度(SPO2)(動脈血中のヘモグロビンがどのぐらい酸素と結合しているかを示す指標)を調べる医療機器が、日本人の発明であることを知りました。それを見て『医学には工学が寄与できる』と確信しました。新しい画期的な診断・治療法を生み出すには、医学者以外の研究のバックアップが、とくに工学の力が必要なんです」
吉川教授の研究のモットーは「継続は力なり」だ。工学の研究では、たとえ成果が出なくても「また次がんばろう」で済むが、医学の研究はその成果を待ち望む患者の生命がかかっている。研究が中途半端に終ってしまっては、何も結果が得られない。だからこそ、汗をかいてコツコツと毎日データを積み上げていく努力が大切になると吉川教授は言う。

1974年、静岡大学工学部電子工学科卒業。1976年、同大学院工学研究科電子工学専攻修士課程修了。1994年、東京工業大学博士(工学)。1974年、日本電気株式会社に入社。1983年、マサチューセッツ工科大学客員研究員。1988年、日本電気株式会社マイクロエレクトロニクス研究所課長。1994年、日本電気株式会社ULSIデバイス開発研究所部長。1998年、広島大学ナノデバイス・システム研究センター教授に就任。2001年、独立行政法人産業技術総合研究所主任研究員併任。半導体MIRAIプロジェクトLow-k材料配線技術グループリーダーなどを務める。2008年5月から、広島大学ナノデバイス・バイオ融合科学研究所の所長に就任。

1986年に文部省令により設立された「集積化システム研究センター」を前身とし、半導体ナノデバイスと医療・分子生命科学との融合基盤技術にもとづく新たな産業を創出するため、2008年5月1日に改組された。東京医科歯科大学、東京工業大学、静岡大学の各研究所と連携し、ネットワーク型の「生体医歯工学共同研究拠点」を構築する。組織は「ナノ集積科学」「集積システム科学」「分子生命情報科学」「集積医科学」の4つの研究部門で構成され、我が国でも有数のスーパークリーンルームをはじめとする設備で最先端の研究が行われている。
【取材・文:大越裕/撮影:吉岡小百合】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png