

日本で、発症すると4人に1人が命を落とす感染症が広まっていると聞いたら驚くだろうか――。その名も「重症熱性血小板減少症候群(SFTS)」、治療法や予防法は確立されていない。
世界に目を向ければ、やはり治療法や予防法が未開発の数々の感染症に、人類は脅かされている。致死率40~90%、2014年に西アフリカでのアウトブレイク(大流行)が世界を震撼させた「エボラ出血熱」もそのひとつだ。
長崎大学熱帯医学研究所の安田二朗教授は、SFTSやエボラなど、ここ50年ほどの間に発見された「新興感染症」の脅威から人類を守るべく、研究に取り組んでいる。ラボでの基礎研究から、感染症に苦しむ地域での治療体制の確立に至るまで、その舞台は幅広い。
「これを見てください」
そう言って安田教授が見せたのは、ピンポン玉ほどの大きさはあろうかという茶色い塊だ(写真参照)。
「これが、血を吸って大きくなったマダニです。血を吸う前のマダニはだいたい数mm程度ですから、血を吸うことで何倍にもなります。ものによっては、数十倍にもなることがあります」
このマダニが、「重症熱性血小板減少症候群(SFTS)」の病原ウイルスを媒介する運び屋だ。
SFTSに感染すると、発熱や消化器不全の症状が見られ、血液中の血小板や白血球が顕著に減少する。血小板は血液を凝固させる役割を担い、それが減少すると、全身のさまざまな臓器で出血が止まらなくなることもある。2009年ごろに中国で症例が報告され、2011年に原因ウイルス(SFTSウイルス)が特定された「新興感染症」のひとつである。

(写真左)2014(平成26)年に新設された熱帯医学研究所附属の「熱帯医学ミュージアム」で、「重症熱性血小板減少症候群(SFTS)」について解説する安田教授。パネルを指差した先にあるのは、SFTSを媒介するマダニの写真だ。指先の小さく見える黒丸が血を吸う前の姿、右の大きな黒丸が、血を吸って大きくなったマダニの姿。(写真右)血を吸って大きくなったマダニの標本も展示されている。
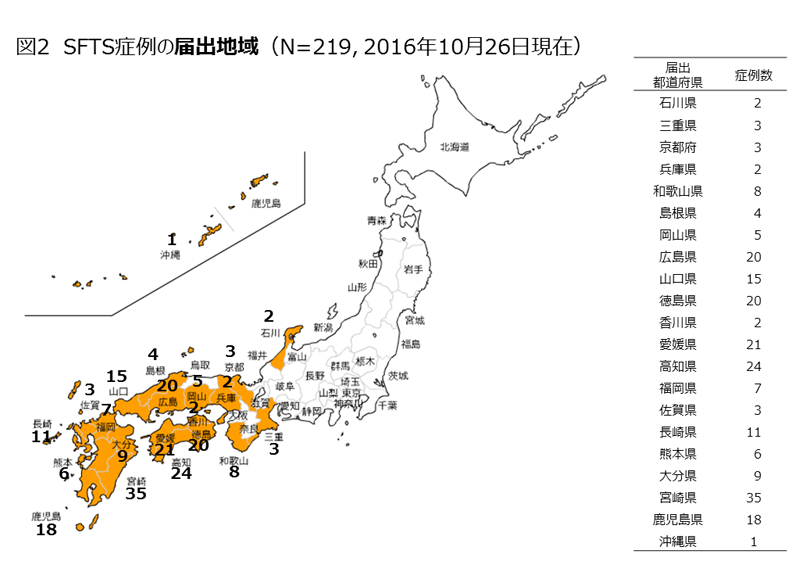
「重症熱性血小板減少症候群(SFTS)」の感染確認地域(出典:国立感染症研究所 http://www.nih.go.jp/niid/ja/diseases/sa/sfts.html 2016年10月26日現在)。感染が西日本に集中しているのが見て取れる。
日本でSFTSの発症が初めて確認されたのは2013年1月のことだ。
2012年秋、山口県の成人女性が原因不明の発熱と嘔吐や下痢の消化器不全を訴え入院、血液検査で血小板と白血球の顕著な減少が見られたが、原因の特定には至らず、症状が悪化して亡くなった。その後の検査によって、患者の血液からSFTSウイルスが見つかり、SFTSと診断された。
この症例をもとに、過去の類似症例について後追い調査をしたところ、遅くとも2005年には、日本でSFTSを発症した患者がいたことが明らかにされた。2016年10月現在、西日本を中心に219名の感染が確認され、そのうち50名が亡くなっている。
SFTSに感染すると、およそ4人に1人が死に至り、日本で確認されているウイルス感染症のなかでは病原性の高さが際立つ。だが、効果的な治療薬は存在せず、感染を特定できても有効な治療ができないのが現状だ。
「感染症例のうち11例は長崎で発症し、長崎大学病院にも患者が運び込まれてきました。治療法のない病気に感染した患者さんがすぐ近くにいるわけですから、ウイルス研究者としては、自分の問題と感じずにはいられません」と、安田教授は危機感をにじませる。
そして、教授らの研究により、抗ウイルス薬開発に光明がもたらされつつある。
「富山化学(富士フイルムグループ)が抗インフルエンザ薬として開発し、エボラ出血熱に効果があるとされる『ファビピラビル(T705、商品名アビガン)』が、マウスの実験で、SFTSウイルスに対しても効果があることを突き止めました。ヒトでの効果も確認され、治療薬の候補になることを期待しています」
なお、ウイルスを持ったマダニは全国から見つかっているが、すべてのマダニがウイルスを保有しているわけではない。さらには、ウイルスを持つマダニに噛まれたからといって、必ず感染するわけでもない。また、マダニは屋外の野山や森林、草地などに生息し、家の中に生息しているイエダニやツメダニとは種類が異なる(大きさも、マダニが数mmから1cmほどあるのに対し、イエダニやツメダニは1mmにも満たない)。
すなわち、屋内で日常生活を過ごすことが多い人にとって、SFTFウイルスはそれほど感染リスクの高い病原体ではない。その点は安心できるポイントだが、備えは必要だ。野山に出かけるときは肌の露出を極力減らし、マダニに噛まれないようにするのとあわせて、もうひとつ注意すべきことがある。それがペットだ。放し飼いや散歩中のペットが、屋内にマダニを持ち込むこともある。ペットを飼っている場合は、ペットにマダニがとりついていないか、定期的に確認することも、SFTS感染を防ぐ手立てとなるだろう。

実験中の学生に声を掛ける。実験の進み具合を尋ね、問題に直面しているときは、ともに解決策を探る。
安田教授の研究対象は幅広い。インフルエンザウイルスやヒト免疫不全ウイルス(HIV)、出血熱を引き起こすエボラウイルスやマールブルグウイルス、ラッサウイルスやクリミア・コンゴ出血熱ウイルスなどに加え、2016年のリオデジャネイロ五輪に前後して、南米で感染が広がったジカ熱を引き起こすジカウイルスも含まれる。ウイルス研究者の多くが、特定のウイルスに絞って研究に取り組むのとは対照的だ。
2014年、西アフリカ諸国で起きたエボラ出血熱のアウトブレイク(大流行)が、世界を震撼させたことを覚えている人は多いだろう。このときは28,616人がエボラウイルスに感染し、11,310人の命が失われた(厚生労働省発表)。40%近い致死率だ。
感染者・死傷者がこれだけ増えた理由のひとつとして、有効な治療法がないことが挙げられる。エボラウイルスを10年以上研究してきた安田教授は、このときのアウトブレイクを、歯噛みする思いで見ていたという。エボラを治療する抗ウイルス薬をつくる――。そのために、安田教授は創薬研究を加速させている。
安田教授が創薬のターゲットとして狙いを定めるのは、ウイルスの増殖過程で見られるある挙動だ。
「私が研究しているウイルスは、どれも共通して、『エンベロープ』と呼ばれる膜を持ちます。エンベロープ・ウイルスの多くは、ウイルスの増殖過程の最終段階、細胞からウイルスが出ていく挙動に共通点が見られます。その過程を阻害する薬がつくれれば、複数のウイルスに対して効果が見込めます」
ウイルスは、生物と無生物の狭間に位置づけられる存在である。生物と同じように遺伝情報として核酸(DNAもしくはRNA)を持つが、ウイルス単体では、動き回ることも自身を増やすこともできない。そのウイルスが、どのようにして人に感染症を引き起こしているかというと、生物の細胞の仕組みを利用し、自身を増殖させているのである。
ウイルスの増殖プロセスは、おおむね次のとおりだ(下図もあわせて参照)。1)まず、生物の細胞膜表面に吸着し、2)細胞内に侵入する。3)ついで、「カプシド」と呼ばれる核酸(DNAもしくはRNA)を包むタンパク質の殻を脱ぎ(脱殻)、細胞内にウイルス自身の遺伝子を放出する。4)そして、細胞が自身の遺伝子を複製・発現する仕組みを利用して、細胞にウイルスの部品をつくらせる。5)続いて、細胞につくらせたウイルスの部品が細胞膜周辺でウイルス粒子を形成し、6)細胞の外に飛び出していく(出芽)。このうち、最後の「出芽」の過程が、多くのエンベロープ・ウイルスで共通しているのだ。
「エンベロープ・ウイルスの粒子形成・出芽を阻害する化合物の探索に力を入れています。まずは、出血熱を引き起こすエボラウイルスやマールブルグウイルス、ラッサウイルスなどにターゲットを絞り、粒子形成・出芽を妨げる化合物の選定を行っています」
化合物の選定(スクリーニング)で力を発揮するのが、長崎大学が誇る、創薬開発専門のスーパーコンピューターだ。その名は「DEGIMA2」。スパコンのノーベル賞とも言われる「ゴードン・ベル賞」に2度輝いた「DEGIMA」を、創薬向けに改良した。ラボでの実験も並行し、薬剤の探索に力を入れている。

ギニア共和国に無償供与されたエボラ迅速検査キット。日の丸の右に見えるのは、ギニア共和国の国旗だ。小型でバッテリー駆動が可能なため、医療設備や電力環境の整っていない場所でも使うことができる。約20分でエボラウイルスの遺伝子を検出可能。
感染症による被害を減らすには、感染者を早期に発見し、感染が広がるのを防ぐことも重要だ。エボラの感染が報告されているのは、アフリカ諸国である。社会インフラや医療体制が十分とは言えない環境で、いち早くかつ簡便に、感染を突き止めなければならない。そのために、安田教授らはエボラウイルスの迅速診断キットを開発した(写真参照)。
「この診断キットを使えば、血液や尿、唾液などの検体から、エボラウイルスの遺伝子を20分以内に検出することができます。バッテリー駆動が可能で、重さ1.7kgと持ち運ぶこともできるため、医療施設のない町や村に持って行き、その場で診断することもできます」

「研究は何をやっても面白い」と安田教授は笑顔を見せる。知的好奇心と同時に、人類を感染症の脅威から守ることへの使命感も強く意識する。それが、教授を幅広い取り組みへと向かわせる原動力だ。
研究室での遺伝子解析には、「PCR(ポリメラーゼ連鎖反応)」による遺伝子増幅が用いられるが、安定した電力が不可欠で、アフリカの電力事情を考えると導入は難しい。そのため安田教授らは、よりシンプルに遺伝子検査ができる原理を応用し、キット開発に取り組んだ。その原理とは、日本の臨床検査薬メーカーである栄研化学が開発した「LAMP(Loop-mediated Isothermal Amplification)法」である。
開発は、安田教授の研究室と医療機器メーカーの東芝メディカルシステムズ(当時は東芝)が共同して進められた。2015年4月には、開発されて間もない診断キットが、西アフリカのギニア共和国に日本政府から8,000セット無償で供与された。ギニアは、2014年のアウトブレイクで、多くの被害者が出た国の一つである(2,500人近くが命を落とした)。安田教授も、キットを用いた治療体制確立支援のために現地へ向かった。
また、同じ仕組みを応用し、ジカ熱用の迅速診断キットの開発も進む。リオ五輪の直前、2016年7月からブラジルで評価試験を行い、実用化のめどを立てた。
安田教授はそのほかにも、ナイジェリアやガボンなど、感染症に苦しむアフリカ諸国に足を運ぶ。現地で広がる感染症について研究を深めるほか、現地の診断体制構築を支援するためだ。ラボだけではなくフィールドも、安田教授の研究の舞台である。
実は、エボラ出血熱とジカ熱の迅速診断キットには「元ネタ」がある。安田教授はかつて、警察庁科学警察研究所でバイオテロ対策に携わっていた。そのとき、バイオテロに使用される恐れのある複数の「生物剤」の遺伝子を一度に検出できるシステム「Bio Bulwark」を開発した。スーツケース型で、一人で持ち運ぶことができる。
対象の生物剤は、エボラウイルスや炭疽菌など19種類。このときも、東芝メディカルシステムズ(当時は東芝)と共同でシステムを開発し、遺伝子増幅の手法として「LAMP法」を応用した。遺伝子検出の方法としては、東芝メディカルシステムズ(同上)が開発したDNAチップを使用した。
それ以前、日本の警察に導入されていたのはアメリカ製のシステムだ。操作性や検出感度のみならず、コストパフォーマンスも大きく改善した。
「本体価格を、従来の2000万円から1500万円へと4分の3に抑えたのに加え、1度の検査にかかる費用も劇的に削減しました。元のシステムでは、一度に1種類しか検出できず、2~3万円かかっていたのに対して、新たに開発したものでは、19種類を一度に調べて1万円にまで抑えることができました。感度も大きく改善し、装置を輸入していたアメリカからも売ってほしいと言われるようになりました」
このシステムは、今では主要な都道府県警察のテロ対応専門部隊に配備され、平成26年度には、科学技術分野の文部科学大臣表彰科学技術賞(開発部門)を受賞した。
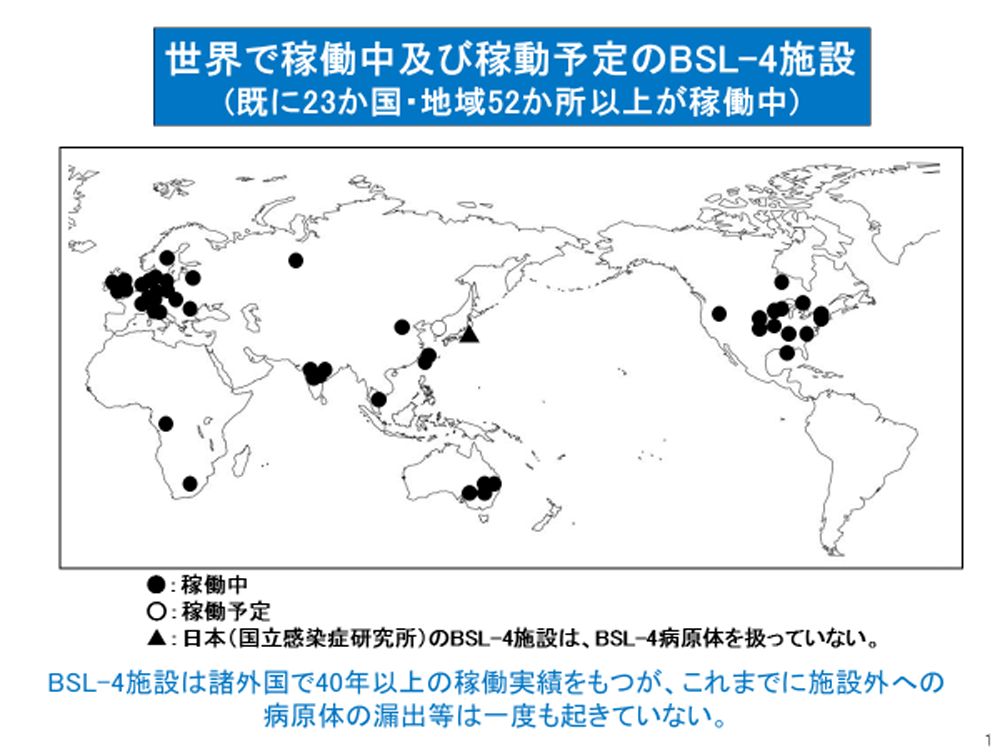
世界23カ国で稼働する52のBSL-4施設。東アジアでは台湾や中国でも施設が稼働し、韓国でも建設され稼働準備中である(韓国は23カ国に含まない)。また、先進国以外では、アフリカ(南アフリカ・ガボン)やインドにも施設がある。(画像は安田教授提供)
ラボとフィールドを行き来し、さまざまなアプローチでウイルスと向き合う安田教授が、ここ数年、特に力を入れて取り組んでいることがある。「BSL-4(Biosafety Level 4)」と呼ばれる施設の建設計画だ。
数ある病原体を、WHO(世界保健機関)の指針に基づいて、各国がリスクの程度によってレベル分けしたものが「BSL(バイオセーフティレベル)」だ。このうち、有効な治療法がなく、発症すると致死率の高い病原体が、もっともリスクの高い「BSL-4」に分類される。そこには、エボラウイルスをはじめ16種類のウイルスが登録され、厳重なウイルス封じ込め設備のある施設(BSL-4施設)での扱いが強く勧告されている。
「WHOの基準や勧告は各国で法律として整備され、先進諸国を中心に、世界23カ国で52の施設が稼働しています。日本でも『感染症法』として法整備されていますが、長いこと、BSL-4の病原体を扱える施設が未稼働でした。エボラ感染が疑われる患者が見つかっても、厳密な確定診断も治癒の確認もできません。先進諸国G8でBSL-4施設が使えないのは日本だけという、世界に申し開きのできない状態が続いていました」

長崎大学が建設を計画しているBSL-4施設の模型。病原体が外部へ漏れ出ることのないよう、厳重な安全対策がとられている。
ようやく2015年8月になって、東京・武蔵村山にある国立感染症研究所の施設が、国内初のBSL-4指定を受けた。2014年のエボラのアウトブレイクがきっかけだが、1981年に設立されたまま、住民同意が得られずBSL-4施設としては未稼働の状態が続いていた。「先進国としての責務を果たせているとはとても言えない状況だった」と安田教授は漏らす。
この状況を打開するため、長崎大学は2010年にBSL-4施設の設置検討を正式に表明した。片峰茂学長を中心に、安田教授らがワーキングメンバーとなり、熱帯医学研究所がある長崎大学医学部キャンパス内への設置を目指している。目下、建設計画の準備と住民理解を得る活動が並行して進んでいる。
現代の遺伝子改変技術を使えば、感染力のない「偽物」のウイルスをつくることもできる。それにより、BSL-4施設がなくとも、研究はある程度まで進められるが、厳密な確定診断や治癒確認、薬の効果の確認のためには、どうしても「本物」のウイルスが必要だ。すなわち、BSL-4施設が不可欠である。さらには、ウイルスが病気を引き起こすメカニズムの解明や、ワクチンや治療薬の効果の確認など、基礎研究もBSL-4施設の重要な目的のひとつである。
安田教授をはじめ、BSL-4に分類されるウイルスを研究する日本の研究者は、海外のBSL-4施設を借りて研究に取り組んできた。安田教授は約10年にわたり、英国や南アフリカの施設を利用してきた。
海外の施設を使えるなら、それをこれからも使わせてもらえばいい。危険なウイルスの研究を、わざわざ日本でする必要はないのではないか――。そういう声が寄せられることもあるようだが、安田教授は次の2つの理由を挙げ、日本に施設を持つ必要性を強調する。
「ひとつは、わが国の感染症対策のためです。ウイルス感染症の確定診断を海外に依頼すると、輸送も含めて時間がかかります。もし、世界的に大流行が起きている状態なら、日本のものは後回しにされかねず、その間に患者さんの病態が悪化するばかりか、国内にウイルスが広まってしまう危険性があります。さらには、2001年の米国同時多発テロ以降、テロへの警戒が強まり、国外の研究者がBSL-4施設を使うことが制限されるようになっています。どの国も、安全保障・国防の観点でBSL-4施設を建設・運用しています。いつ、国外施設の利用ができなくなるかもしれません。2つ目は、世界の感染症対策への貢献、つまり国際貢献のためです。新興感染症が出現するのはアフリカやアジアの発展途上国です。これらの国が、自国の力だけでこれらに対応することは困難です。科学技術大国の一つである日本がワクチンや治療薬の開発などにおいてリーダーシップをとり、世界の感染症対策に貢献する。それは、国際社会の一員としての責務であり、ひいてはわが国自身を守ることにつながるのです」
長崎は、江戸時代から世界と日本をつなぐ玄関口としての役割を果たしてきた。それと同時に、コレラや麻疹、天然痘などの輸入感染症の影響を真っ先に受けてもいる。幕末の1857年、感染症対策としてこの地につくられた長崎医学伝習所の系譜が、今日の長崎大学医学部や熱帯医学研究所に受け継がれている。
BSL-4施設の稼働は、日本で感染症やウイルスの研究に携わる人たちの長年の悲願だ。ラボとフィールドの行き来に加え、研究環境整備を目指し、安田教授はウイルス研究の最前線にいる。

1966年名古屋市生まれ。1991年北海道大学獣医学部卒業、1994年総合研究大学院大学生命科学研究科博士課程(理学)を修了後、米国アラバマ大学で博士研究員、東京大学医科学研究所で助手を経て、2000年に北海道大学遺伝子病制御研究所助教授に就任。2003年、バイオテロ対策を担う警察庁科学警察研究所・法科学第一部・生物第五研究室の室長として生物剤検知システムの開発に携わり、2010年より現職。2014年、「モバイル型生物剤検知システムの開発」の業績により、平成26年度科学技術分野の文部科学大臣表彰(科学技術賞)を受賞。

長崎大学熱帯医学研究所は、熱帯病のなかで最も重要な領域を占める感染症を主とした疾病と、付随するさまざまな健康問題の克服を目指す組織である。関連機関と協力し、1)熱帯医学・国際保健の分野における先導的研究、2)研究成果を応用した熱帯病の防止と健康増進、3)1と2の分野における研究者と専門家の育成、の3つに取り組む。1942(昭和17)年3月に設立された長崎医科大学附属東亜風土病研究所に端を発し、その後の幾度かの大学組織の変更を経て、1967(昭和42)年6月に現在の組織となる。「病原体解析部門」「宿主病態解析部門」「環境医学部門」「臨床研究部門」のなかに、13の研究分野がある。
【取材・文:萱原正嗣/撮影:山本薫】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png