

科学の進歩に貢献するのは、自然の真実に迫る発見だけではない。実験手法の開発も重要だ。新たな実験手法が実用化されると、研究者らは、これまでアプローチできなかった難問に挑むことができるようになる。研究は次のステージへ引き上げられ、科学の歴史が大きく塗り替えられることもある。
広島大学放射光科学研究センター(HiSOR)の松尾光一准教授らのグループは、世界で初めて、「放射光真空紫外円二色性分光法」を実用化し、生体内で働く分子の構造を解析する新たな道を切り拓いた。一体どのような方法なのか、それによって何ができるのか。詳しい話を聞いた。
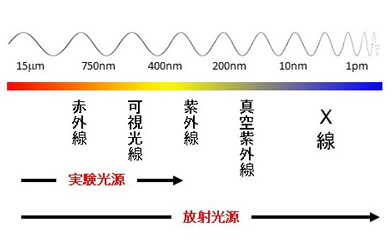
図1 電磁波の波長の違いを表す模式図。波長が100µm以上の長い電磁波を「電波」(図には記されていない)、10nm~10pmの波長の短い電磁波を「X線」、その間の波長の電磁波を「光」(赤外線・可視光線・紫外線)と呼ぶ。
人間の目が感知できる光は「可視光」と呼ばれる。光は波の性質をもった電磁波の一種で、電磁波は波の周期の長さ(波長)によって異なる名前がついている(図1)。
私たちの目は、可視光線が物に当たって反射した状態を感知して、物を見ている。このように、物を「見る」ためには、可視光線を含む電磁波を物に当てる必要がある。物に当たった電磁波は、吸収されたり反射されたり回折したりして、変化する。このときどのように変化したかを詳細に解析すれば、物の姿を知ることができる。
可視光線では小さな物を見ることはできない。たとえば、数nm~数十nmほどの大きさしかない生体内のタンパク質は、可視光線の波長(約400~800nm)だと波と波の間に入ってしまい、その姿を捉えることができない。一方、短い波長のX線なら、数nmの大きさのタンパク質でも精密に解析することができる。
タンパク質の構造解析によく使われる手法が、「X線結晶構造解析」だ。ただしこの手法は、その名の通り、測定するには試料を結晶化しなければならない。生体内で働く分子の研究を行うには、結晶化した状態を調べるだけでは十分ではない。その理由を松尾准教授は次のように説明する。

丁寧に説明してくれる松尾准教授。
「タンパク質や糖などの生物の体の中で働く分子は、細胞内外の溶液中に存在して働いています。それらの生体分子を溶液から取り出して結晶化した構造は、体内での状態や構造と異なっている可能性があります。さらに、ほとんどの生体分子が、他の分子との相互作用により構造を変化させることで機能を発揮しますが、結晶化してしまうと、そのような反応過程を詳細に見ることが困難です。そのため、生体内の環境に近い、溶液中に存在する状態で、機能を持った分子の構造も観測する必要があるのです」
溶液中の分子の構造を解析するためによく使われるのが「円二色性分光法」だ。これは、生体分子中に存在する「鏡像異性体」を検出し、それを手掛かりに立体構造を解析する方法だ。
鏡像異性体とは、同じ原子で構成されているが、右手と左手のような鏡合わせの原子配置になっていて、重ね合わせることができない関係の分子のことだ(図2参照)。このようなペアはアミノ酸や糖などで主に見られ、ペアの片方をL型、もう片方をD型と呼ぶ。人工的に合成した場合にはL型とD型は1:1の割合で生成されるが、不思議なことに、地球の生物を構成するアミノ酸や糖はどちらかの型に偏っている。アミノ酸の場合、99%以上がL型で、糖はほとんどがD型である。
この鏡像異性体を見分ける特殊な電磁波の成分が「円偏光」だ。一般的に電磁波は振動しながら伝わるが、振動方向が円形にくるくる巻きながら進むのが円偏光だ。円偏光には進行する方向に対して左回りと右回りがあり、鏡像異性体を形成する原子配置によって、右回り円偏光と左回り円偏光の吸収する割合が異なる。これを「円二色性」と表現する。この性質を用いることで、鏡像異性体の立体構造の違いを見分けることができる。

放射光施設内でディスカッションする松尾准教授と研究メンバー。学部や大学院の学生も施設内で実験を行っている。
この割合は、当てる光の波長によって異なる値をとるため、波長を変えて測定した複数のデータを総合的に解析すれば、いろいろな倍率のレンズで覗くように、その波長で見える構造が分かり、最終的に分子全体の構造を決定できる。円二色性分光法はX線結晶構造解析と違い、分子がどんな方向を向いていても解析できるため、溶液中でも解析できることが大きなメリットだ。
しかし、この円二色性分光法にも問題があったと松尾准教授は説明する。
「円二色性分光法は、測定可能な波長範囲が広いほど、たくさんの構造に関するデータが得られます。ところが紫外線ランプなどの実験室光源をもちいた従来の方法では、大気の光吸収や光学システムの問題で、190nmより短い波長を測定することが困難でした」
測定範囲を広げるためには、もっと波長が短くエネルギーの高い電磁波を発する光源と新しい光学システムが必要だった。そこで松尾准教授らは、大学内に新設されたばかりの放射光施設を光源とし、装置開発の挑戦を始めた。放射光を光源とし、従来の方法よりも短い波長領域である「真空紫外領域」の光を取り出して、円二色性分光法を行う「放射光真空紫外円二色性分光法」の開発がスタートした。
「この真空紫外領域に特化した装置開発の取り組みは、私たちが世界で一番早かったと思います」と松尾准教授は振り返る。

HiSORの内部の様子。現在、東北大学も放射光施設を建設しており、2023年に完成予定だが、その完成の日までは広島大学はキャンパス内に放射光施設を持つ唯一の国立大学だ。
終始控えめで穏やかに話す松尾准教授が、自信をもって一番だと言い切るには理由があった。放射光を発生させて実験するには専用の巨大な施設が必要で、誰でも簡単に取り組めるものではないからだ。
現在稼働している大型の放射光施設が完成したのは1994~1997年だ。1994年にヨーロッパ18か国が共同開発したESRFがフランスに、1996年にはアメリカにAPSが建設され、そして1997年に世界最大の放射光施設SPring-8が日本に完成した。広島大学放射光科学研究センター(HiSOR)はSPring-8が稼働し始めた時期に重なる1996年に設立された。
松尾准教授らは、HiSORの完成時期とほぼ同じ頃にこの研究をスタートさせた。
「HiSORが完成したのは、私が学部生のときです。すごい施設ができたと授業中に先生が興奮気味に話していたのを覚えています。4年生のときはSPring-8でX線結晶構造解析を専門とする先生のもとで研究を行っていましたが、博士課程前期に上がるときに他の先生に誘われて、HiSORで放射光を使った円二色性分光法の開発を行うことになりました」
学生でも放射光実験が気軽に行えるのは、キャンパス内に放射光施設があるメリットのひとつだ。大きな施設だと学生が気軽に行って実験することはなかなか難しい。世界初の解析法を開発できた理由を松尾准教授に尋ねると「環境ですかね」と答えが返ってきたが、放射光を使った円二色性分光法が誕生するには、放射光施設が自由に使える環境と、円二色性分光法を改良したい研究者、という2つの条件がそろう必要があったのだ。
まだ誰も成し遂げていない未踏の領域の実験手法の開発は、試行錯誤の連続だった。実験が行き詰っても、誰にも聞くことができない。測定がうまくいかなかったときは、根気強く装置を分解していき、その原因を突き止めた。2000年には、放射光を用いた真空紫外領域の光で、溶液中の生体分子の立体構造の解析を行うことができた。これにより、観測できる波長の範囲は190nmまでから140nmにまで広がった。
この50nmの拡張で、生体分子の新たな姿が見えてきたのである。
波長の長さを横軸に、円二色性(CD)を縦軸にプロットしていくと、波の形をしたグラフのようなものが現れる。これは分子の構造に対応するグラフで、「円二色性スペクトル」と呼ばれる。このスペクトルを見れば、試料の中にどんな分子構造が含まれているかを知ることができる。いわば、指紋のようなものだと松尾准教授は説明する。
「図3はよく似た構造の3種類の糖の円二色性スペクトルを示しています。190nmまでしか見ることができなかったときは、3つの糖の区別がつきにくかったのですが、140nmまで測定範囲が広がった結果、3つの糖のスペクトルに明らかな違いが見えてきました。また図4のように190nmより短い波長領域にスペクトルの山が2つあるようなアミノ酸は、この方法で解析精度が格段に上がりました」
放射光を使ったメリットは測定の幅が広がっただけではない。紫外線ランプなどの実験室光源に比べて10万~10億倍も強度がある放射光を用いたおかげで、測定時間が短縮でき、解像度の高い結果を得ることもできた。
松尾准教授らの研究グループは、放射光真空紫外円二色性分光法を用いた観測結果と、分子シミュレーションを融合させ、これまで観測が困難だった溶液中の微細構造を発見し、複数の成果を発表した。2012年には、水中で糖類の動きを観測し、機能に影響を及ぼす糖の周辺の水分子の分布を解明した。2014年には、アルツハイマー病の原因物質であるアミロイド線維(タンパク質)の毒性を、アミノ酸残基レベルの構造から解析した。また2017年には、DNAの損傷修復などに関わる重要なタンパク質である「ヒストン」の構造変化の仕組みも解明した。
生体内で働く分子の機能の解明は、生命の秘密に近づくだけではなく、創薬や新しい治療法の開発など、医学応用につながる可能性が高い。現在、放射光真空紫外円二色性分光法を使えるのは、日本ではここHiSORのみだ。この魅力的な新手法に関心を寄せる研究者は多い。松尾准教授らは共同研究を積極的に受け入れながら、新手法の可能性を広げている。
なぜ研究者になることを決めたのかと尋ねると「研究がうまくいかなかったから」という意外な答えが返ってきた。
「博士課程前期から始めた研究は、ずいぶん長い間うまくいきませんでした。当時は、指導教官と私の2人だけのチームでした。新しい手法だったので、行き詰まると指導教官も分からない。『これ以上悪くならないからがんばれ』と励まされました。先輩もいなかったので、聞く人もいません。でも、分からないからやめたいとは思わなかったのです。むしろ、なぜうまくいかないのかを知りたくて、博士課程後期に進みました」

手慣れた様子で装置のメンテナンスを行う松尾准教授。
現在、松尾准教授は実験を行うだけでなく、装置のメンテナンスや測定結果の解析プログラムの開発まで手掛けている。規模の小さい施設だからこそ、何でも屋にならざるを得ない。しかし、そのおかげで、試料の作成から解析まで、すべての経験と知識が松尾准教授の中に蓄積していく。
「どんなことの中にも役立つことが必ずあると思います。むしろ、興味があるけど無駄かもしれないことこそ、チャレンジするべきかもしれません。役に立つと分かっていることは、すでにほかの人がやっています。後から始めて追いつくのは難しい。でも、見向きもされないことは誰もやりません。しっかり研究を続けていけば、チャンスが拓けて一番になれるかもしれません」
トンネルを掘り進めるようにこつこつと研究を続け、新たな道が切り拓かれる。その道をたくさんの研究者たちが通り、また新たな道が生まれていく。そんな研究の進化の過程を垣間見ることができたインタビューだった。


1996年に学術審議会によるヒアリングを経て設立。放射光利用研究の推進と人材育成を目的として、広島大学のキャンパス内に設置された。2002年に全国共同利用施設として新設され、2010年に共同利用・共同研究拠点(放射光物質物理学研究拠点)として認定された。小型放射光源から発生する真空紫外線・軟X線域の放射光を利用し、世界最先端の計測技術で物質物理学研究を推進している。
【取材・文:寒竹泉美 撮影:吉岡早百合】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png