

ウイルスとは何か。あらためて問われると、ひとことで答えるのは決して簡単ではない。もとよりウイルスは、定義では「生物」ではない。けれどもウイルスは、生物である細菌と同じように生物の体内に入り込み、病気を引き起こす。遺伝子を持ち、タンパク質によって構成され、細胞に依存しながら自己複製を繰り返すウイルスの中には、ときに新型コロナウイルスのような災いをもたらすものも現れる。
ところが、そのウイルスに由来する遺伝配列が、ヒトのゲノムの中に組み込まれているばかりか、生命を維持する上で重要な役割を果たしてもいる。そんなウイルスの不思議にひかれて研究に取り組んでいるのが、京都大学ウイルス・再生医科学研究所の朝長啓造教授だ。教授はレトロウイルス由来とは異なる新たな内在性ウイルスを世界で初めて発見し、このウイルスの特徴を活用したウイルスベクターを開発することで難病治療に挑んでいる。
ウイルスとは、不思議な「モノ」だ。あえて「モノ」と表現する理由は、あたかも生物のように振る舞いうにもかかわらず、決して生物ではないからだ。
「ウイルスは細胞に依存しないと自己複製できないので、生物とはいえません。だから生き物ではなく、遺伝物質をもつ粒子というのが正確なところでしょう」と、朝長啓造教授はウイルスの定義から話を始めた。

朝長教授は、1998年にボルナウイルスの研究に取り組み始めた。それから約20年、一つの研究テーマを追い続けるなかで数多くの成果を出している。
ところが、そのウイルス由来の遺伝配列が、ヒトのゲノムに組み込まれている。ヒトだけでなく、ほかの生物でもウイルス由来配列がゲノムに見つかっている。これら生物のDNAに組み込まれているウイルス由来の配列を総称して「内在性ウイルス」と呼ぶ。
実はヒトのゲノムのうち、およそ8%がレトロウイルスに由来する「内在性レトロウイルス」、すなわちウイルス由来の遺伝配列である。これに対してヒトゲノムでタンパク質の発現に関わる「遺伝子」領域は、全ゲノムの約1.5%に過ぎない。単純計算でヒトゲノム上でウイルス由来の配列が占める領域は、遺伝子領域の5倍以上もあるわけだ。
「しかも近年の研究により、内在性レトロウイルスが生物の生存に影響を与えている事実も明らかになっています。内在性レトロウイルス配列やその転写産物は、ヒトの免疫系の活動に重要な役割を果たしているばかりか、ヒトを含む哺乳類の胎盤形成でも、レトロウイルスから取り込んだ遺伝子が利用されています」
ドイツ南東部では、ウマに‘Kopfkrankheit’と呼ばれる神経性疾患の流行が古くよりみられていた。1767年刊行のウマの治療に関する教科書に、その疾患に関する記載がある。19世紀に入ると各地で大きな流行が相次ぐようになる。そして、1894年にはザクセン州のボルナという町で軍馬が多数罹患する流行が発生し、その病気は「ボルナ病」と呼ばれるようになった。20世紀に入ってようやく、「ボルナ病」の原因がウイルス感染であることが明らかになり、同定されたウイルスは「ボルナ病ウイルス」と名付けられた。
「このボルナ病ウイルスを含むウイルス科名がボルナウイルス、私が20年以上に渡って興味をもち続けている研究対象です」
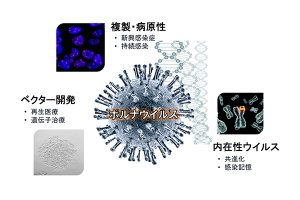
朝長研究室では、次の4つをテーマに研究に取り組んでいる。(1)RNAウイルスの中でもユニークな感染の仕組みを持つボルナウイルスの感染機構の解明、(2)人獣共通感染症の危険性がある新興ボルナウイルスの病原性の解明、(3)内在性RNAウイルスの網羅的検索と進化的意義の解析、(4)ボルナウイルスベクターの開発と応用。
当初ウマやヒツジに感染すると考えられていたボルナ病ウイルスは、やがてヒトにも感染している可能性が明らかになった。これが1980年代半ばであり、その頃からヒトを対象としたボルナ病ウイルスを対象とした疫学研究が盛んになっていく。
しかし、脳内に慢性感染しているウイルスを検出する難しさに加え、ヒトでの感染病態がはっきりとしなかったため、やがてヒトを対象としたボルナ病ウイルスの研究は下火になって行く。そして、21世紀に入ると世界からボルナ病ウイルスを専門的に研究する研究者はほとんどいなくなってしまった。
ところが、そんなボルナ病ウイルスを朝長教授は研究を続けた。その理由について「第一にはウイルスの基礎研究は進んでおらず、ウイルス学的には何もわかっていなかったから」と説明する。
科学者の好奇心をかきたてる解明すべき謎が、宝の山のようにある研究対象、それがボルナ病ウイルスだったのだ。その宝の山の中で、特に研究者魂を刺激する特徴があった。それは、このウイルスがRNAをゲノムとするウイルスでありながら、宿主細胞の核内で持続感染するという点であった。これは他のRNAウイルスには見られないユニークな感染現象である。
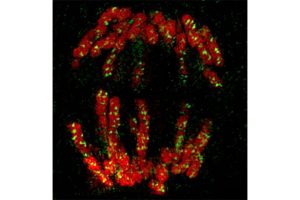
ボルナ病ウイルス感染細胞の分裂後期の超解像顕微鏡画像。免疫蛍光法により染色体を赤、ボルナ病ウイルスのヌクレオプロテインを緑に染色している。ヌクレオプロテインからなるウイルスRNPが、宿主の染色体にしがみつくように存在している様子がわかる。
「ボルナ病ウイルスはRNAウイルスでありながら、宿主への感染の仕方がほかのRNAウイルスとはまったく違う。この謎を解き明かしたいと研究を続けたのです。多くの研究者は、ヒトへの病原性が定かではないボルナ病ウイルスの研究から離れていきました。ボルナ病ウイルスのウイルス学としての面白さを追求しようとしていた研究者は、当時ほとんどいなかったのではないでしょうか」
朝長教授は、丹念にウイルスの複製機構を解析することで、ボルナ病ウイルスが核内で持続感染する仕組みを解明した。ボルナ病ウイルスは、ウイルスの複製複合体であるRNPを宿主の染色体表面に接合させることで核内での持続感染を維持していたのだ。
ボルナ病ウイルスの核内持続感染の仕組みが解き明かされると、朝長教授はこのウイルスのさらに奇妙な性状に気がついた。それは、ボルナウイルスが宿主のゲノムに内在化する可能性があるのではないかということである。当時は、RNAウイルスが生物のゲノムに内在化していることなどありえない、というのが常識だった。しかしながら、ボルナ病ウイルスは生殖系細胞に持続感染し、細胞核内で長期にウイルスRNAを発現させている。ならば、それまでに内在化が確認されていたレトロウイルスとは、異なる仕組みで内在化していても決して不思議ではないはずだ。この常識にとらわれない朝長教授のシンプルな疑問が、世界中が注目する研究成果へとつながっていく。
朝長教授は、動物ゲノムのデータベースを調べ、まずヒトのゲノム上にボルナ病ウイルスの遺伝子ときわめて似通った遺伝配列があることを突き止めた。
けれども、それだけでボルナウイルスの遺伝子が、ヒトゲノムに内在化したなどとは言えない。そもそもボルナウイルスなどまったく関係なく、ヒトの遺伝子の中にそうした配列ができただけかもしれないし、逆にヒトの遺伝子がボルナウイルスに取り込まれた可能性もある。
「ボルナウイルスが内在性ウイルスであるとの証明には、時間がかかりました。共同研究者の力を借りて遺伝学的な解析を進め、ボルナウイルスの進化の系統図を描くなど進化的な解析にも取り組みました。同時に、培養細胞や実験動物を用いて、実際にボルナ病ウイルスが宿主のゲノムの中に組み込まれるかどうかを確かめていきました。こうして2年ぐらいかけて証明を終え、論文として発表しました。」
2010年、朝長教授らは、ボルナウイルス由来の配列がヒトを含む多くの哺乳動物のゲノムに内在化しいることを証明し、これを「内在性ボルナウイルス様配列」と名付けて発表した。
この発表は世界で大きな反響を呼んだ。何しろ半世紀近く続いていた「生物のゲノムに系統的に内在化しているウイルスはレトロウイルスだけである」という常識をくつがえす発見だったからだ。
画期的な発見をきっかけとしてその後、レトロウイルス以外の内在性ウイルスの探索が世界中で活発に行われるようになる。その結果、ボルナウイルスに限らず、ほかのさまざまなウイルスに由来する遺伝配列も、脊椎動物のゲノムの中に取り込まれている事実が明らかになっている。
「ただ、ヒトのゲノムに限定するなら、内在化が明らかになっているのは今のところレトロウイルスとボルナウイルスだけです。もちろん、今後新たなウイルスが見つかる可能性はあります」

朝長教授の部屋にはホワイトボードがある。研究生たちとは常に、これを使って問題点などを書き出しながら議論を進める。
ヒトで見つかった内在性ボルナウイルスの多くは、約6,700から4,300万年前に、霊長類の共通祖先にボルナウイルスが感染した痕跡である。面白いことに、内在化してからすでに数千万年を経ているのもかかわらず、多くの内在性ボルナウイルスは、現在でもウイルス遺伝子と極めて似通った配列情報をもつとともに、細胞内ではRNAに転写され、中にはタンパク質を作り出す能力をもつものまで存在していた。では、これら内在性ボルナウイルスはヒトの進化にどのような役割を担ってきたのか。
朝長教授らは、培養細胞を使った実験により次の事実を明らかにしている。
「内在性ボルナウイルスからつくられるタンパク質やRNAの一部は、現存する外来性ボルナウイルスの感染を抑える機能をもつことがわかりました。つまり生物は、自らに感染したウイルスの遺伝子をゲノムの中に取り込み、長い時間をかけて宿主細胞に適応進化させることで再利用してきた可能性があるわけです」
ボルナ病ウイルスは、宿主の核内で、染色体外RNAとして感染を長期間維持できる。また、その感染は細胞を破壊しない。この「持続感染」と呼ばれる特徴を活かせば、ウイルスベクターとしての利用可能性が出てくる。
朝長教授らは、既にボルナ病ウイルスの人工合成に成功している。そこで次の研究課題の一つとなっているのが、いわゆる「ベクター」としての活用だ。遺伝子の運搬役を意味する「ベクター」は、遺伝子治療や再生医療、がん治療などに活用されている。
「ベクターとして考えてみれば、ウイルスは宿主の細胞に入り込んで遺伝子を発現させる特徴を持つため、医療分野で非常に有望視されています。ウイルスベクターとしてよく知られているのが、レンチウイルスとアデノ随伴ウイルスです。ただレンチウイルスは、細胞のゲノムにレンチウイルスベクターが100%の確率で入り込むため、細胞ががん化するおそれがあります。一方のアデノ随伴ウイルスは、分裂や増殖が盛んな細胞のなかでは、遺伝子を長期間発現させ続けるのが難しい。そのためiPS細胞や幹細胞などの分化増殖が必要な細胞を用いた遺伝子治療を考えた時に、既存のベクターでは使いにくいところがあります」
これらの弱点を克服する新たなベクターとして、朝長教授らはボルナウイルスを活用したREVec(レベック)ベクターの開発に取り組んでいる。ボルナウイルスの特性上、そのゲノムが感染した細胞のゲノムに組み込まれる可能性はゼロに等しい。つまりゲノムへの傷害性はほとんどなく安全である。一方で染色体にしがみついて、分裂する細胞でも感染を維持できるため、iPS細胞や幹細胞のように分化や増殖を続ける細胞でも、治療に必要な遺伝子を長期間に渡って発現し続けられる。
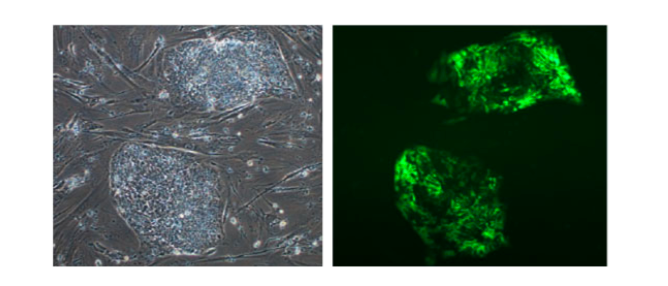
朝長教授らはすでに組換えボルナウイルス技術を応用し、核内で長期間安全に外来遺伝子を発現するボルナウイルスベクター(REVec)を開発している。写真はiPS細胞に導入されたGFP(緑色蛍光タンパク質)を発現するREVec。
「REVecを用いて有用遺伝子を導入した幹細胞を遺伝子治療や再生医療の新たなプラットフォームとして活用できるのではないかと考え、実用化に向けた研究をスタートさせました」
朝長教授らの研究は、2021年度のJSTのSTART(研究成果展開事業 大学発新作業創出プログラム)に採択された。プロジェクトのタイトルは、『新規RNAウイルスベクターを用いた遺伝子治療薬の開発』だ。遺伝子導入した幹細胞を、患者に移植する遺伝子細胞治療のための新たなプラットフォームとする技術開発をめざし、遺伝子細胞治療のスタンダードを提供するベンチャー企業設立までが視野に入っている。
「もちろん実用化に至るまでには、いくつものハードルを越えなければなりません。何よりもまず安全性を確保しなければならない。さらに有効性も生体内で実証していく必要があります。有効性についてはある程度のメドはありますが、安全性については研究者レベルだけでは判定できない内容も含まれるため、今後さまざまな機関と連携しながら進めなければなりません。ボルナウイルスのウイルス的な特徴、即ち神経系細胞に指向性がある点を考えるなら、中枢神経系疾患は重要なターゲットと考えています。また、現時点では治療法がないような難治性疾患を治療できる可能性もあるはずです。もちろん遺伝子治療へのREVecの活用は、これまで一度も取り組まれていませんから、念には念を入れた実証が必要になります」
今ではウイルス一筋の朝長教授だが、子どもの頃の夢は獣医だった。小学校時代から動物図鑑を見て、とくに野生動物に興味を持っていたという。獣医をめざして大学に入り、配属先となった病理学研究室では寄生虫の研究が行われていた。そこで微生物に興味を持ち、ひいては寄生虫が引き起こす病気にも関心が向かう。
「獣医となってからは、より小さな対象となるウイルスに興味を持ち、京都大学のウイルス研究所を経て東京大学大学院で学位を取りました。その後、アメリカで内在性レトロウイルスを研究した後、日本に戻ってからボルナ病ウイルスに取り組み始めたのです」
アメリカからの帰国後、朝長教授は北海道大学から大阪大学、さらに京都大学へと移りながらも、研究テーマは一貫してボルナウイルスで変わらない。ボルナ病ウイルスのヒトへの感染と病原性は長い間謎であったが、近年、ヨーロッパにおいてヒトに感染して致死性脳炎を引き起こしている実態が明らかになってきている。また、動物由来の新興ボルナウイルスがヒトに感染して急性脳炎を引き起こすことも知られるようになった。
「元々が獣医ですし、ウイルス学者としても、感染症から命を救いたいという思いは強くあります。もちろんヒトを救うために、ボルナウイルスを使ったウイルスベクターも何とか実用化まで持っていきたい」
粒子であるウイルスが、どのようにして生物と共存し進化してきたのか。その過程はまだ謎に満ちている。ボルナウイルスに関しても、数千年前までは霊長類ゲノムに侵入していることが明らかにされているが、その後の内在化は確認されていない。
「なぜ、突然内在化がなくなったのか。その理由は、未だに分かっていません。もし原因を突き止められれば、ウイルスが引き起こすパンデミックを防ぐための知見を得られるのではないかと思っています」と、朝長教授はその研究が秘める新たな可能性を語ってくれた。


ウイルス感染症研究と再生医療の技術確立のための研究を行う。1941年発足の結核研究所が胸部疾患研究所を経て1998年に改称した再生医科学研究所と、1956年発足のウイルス研究所が、2016年に組織統合して誕生した。再生医学に革新的な基板を確立する一方で、ウイルス感染症学においても多くの研究者を輩出している。ほかにも免疫学、発生学、幹細胞学、タンパク質科学など幅広い領域において研究を行っている。
【取材・文:竹林篤実 撮影:大島拓也】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png