

新型コロナウイルス感染症の流行に伴い、「抗体」が注目を集めるようになった。抗体とは、免疫グロブリンと呼ばれるタンパク質であり、体内に侵入した病原体などの抗原と結合して異物を排除する。だからコロナといえども、ワクチン接種により抗体が体内にできれば、それほど恐れる必要はない。
このように、抗体が抗原、すなわち特定の物質とだけ結合する性質は、さまざまな用途に応用できる。東京工業大学 科学技術創成研究院 化学生命科学研究所の上田宏教授はタンパク質工学を駆使して、抗体を活用する高精度・高感度なバイオセンサーの開発に取り組んでいる。教授が開発した特殊な抗体“Q-body”を活用するバイオセンサーは、コロナウイルスの感染診断への活用も視野に入っている。
2021年2月、第2回『東京工業大学 国際オープンイノベーションシンポジウム 2021』がオンラインで開催された。シンポジウムに登壇した上田宏教授の発表テーマは『1個体、1分、1ドルで判定可能なコロナ診断装置実現のための蛍光免疫センサーの開発』である。
教授らが目指すのは、コロナウイルス特有のスパイクタンパク質を特異的に認識し、蛍光発色するバイオセンサーの開発だ。2月の発表段階では、結果を得られるまでの時間を数分レベルまで短縮していた。この計測時間を1分にまで短縮するのが最終的なゴールだ。
「我々が開発した蛍光バイオセンサー“Q-body”は、操作が非常に簡単であるのに加えて、検出時間の短さも特徴です。コロナ診断用で目指しているのは、検出までの時間を従来の手法と比べて大幅に短縮し、検査コストもできる限り安価に抑えたシステムです」
上田教授はこれまでタンパク質工学を応用して、抗体を活用する新たな検出・診断方法の開発に取り組んできた。抗体とは、ヒトの体内で病原体などの異物、つまり抗原から身を守るために働くタンパク質である。各種特定の抗原を認識できる抗体はすでに、基礎研究から病気の診断、特定物質の検出、さらには環境汚染物質の簡便な測定法など幅広い分野で活用されている。
「抗体を活用する測定法として、私が約20年前に開発したのが、低分子でも高感度に測定できるオープンサンドイッチ法です」
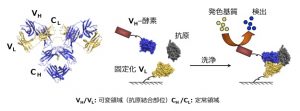
左は抗体の基本的な構造、可変領域(VH・VL)と定常領域(CH・CL)に分けられる。右は抗原をキャッチして、抗体、VHとVLが結合し安定する性質を利用したオープンサンドイッチ法測定プロセスを表したもの。
それまでタンパク質の測定には、2種類の抗体を使うサンドイッチ酵素免疫測定法(ELISA)が使われていた。これは特定の抗原に結合する2種類の抗体(検出抗体・補足抗体)を用意し、抗原を2つの抗体で挟み込むようにして検出する。2種類の抗体でチェックするため測定精度は高い。ただ、その分作業工程で多くの時間を必要とし、また低分子は検出できなかった。
「そこでより使いやすく、低分子も感度よく測定できる方法としてオープンサンドイッチ法を開発しました。抗体はH鎖とL鎖の2本の鎖で構成され、それぞれの鎖は抗原と結合する可変領域(VH・VL)と定常領域に分けられます。オープンサンドイッチ法では、この抗体の可変領域を構成する2つの領域 VH と VL を、人工的に分けて作ったタンパク質(可変領域Fv)を使います。Fv は、抗原のないときには不安定ながら、抗原と結合すると安定化します。従って、当初不安定だった FV の安定度合いにより、抗原濃度を測定できるのです。このオープンサンドイッチ法を使えば、従来のサンドイッチ法では測定できなかった分子量1000以下の低分子化合物も検出できます」
加えて、オープンサンドイッチ法の研究中に発見された現象を元に、新たに開発されたのが、蛍光免疫センサータンパク質である「クエンチ抗体」を活用する Q-body 法である。Q-body も抗原抗体反応を利用して測定する点は従来の測定法と同じだが、より簡単で精度の高いのが特徴だ。
「クエンチ抗体とは、特定の抗原に触れると抗原抗体反応を起こして即座に構造が変化し、蛍光発色するように加工した物質です。発色する蛍光の強さによって、測定対象となる物質が含まれているかどうかを判定できるのです。調べたい物質のサンプル量は、数ナノグラム(ナノ=10億分の1)あれば検出可能です」
クエンチ抗体は、その末端部分を色素で蛍光ラベルしてある。この色素は通常は抗体内のアミノ酸、トリプトファンによって消光(=Quench:クエンチ)されているが、抗原抗体反応を起こすと抗体構造が変化して発光する。反応を起こさせる手順は極めて簡単で、Q-body を含む溶液と測定サンプルを混ぜるだけでいい。その結果発生する蛍光の強度を測定すれば、対象となる物質が含まれているかどうかが分かる。
扱いに専門知識を必要とするサンドイッチ法と違い、Q-body 法は大掛かりな装置が不要で、誰でも簡単に使える点も大きなメリットとなる。しかもサンドイッチ法では数時間を要した免疫測定を、Q-body 法なら数分以内で完了できる。
この Q-body 法では、対象とする物質ごとに専用の抗体が必要になる。抗体作製に要する時間は、対象とする物質にもよるが、早くて2週間程度、かかっても2カ月以内にはできる。これまでに開発された抗体は、覚醒剤、コカインなどの違法薬物、インフルエンザウイルス、カビ毒、農薬などを対象とする30種類程度。加えて今開発中なのが、コロナウイルスを対象とした抗体である。サンドイッチ法では測定できなかった低分子の化合物まで測定可能だ。
Q-body の開発は、2007年にスタートした。そのきっかけは、当時は東京大学に在籍していた上田教授、北陸先端科学技術大学院大学の芳坂貴弘教授、そしてプロテインエクスプレス社による産学連携プロジェクトの立ち上げである。
プロテインエクスプレス社はすでに、無細胞タンパク質合成系を活用する抗体作製技術を開発していた。プロジェクトの目的は、この技術の新たな用途開拓である。そこで免疫測定の専門家として上田教授が招かれたのだ。
「当初は、私が以前開発したオープンサンドイッチ法をベースとし、これを蛍光標識した抗体断片による抗原測定を試していました。私の役割は、蛍光色素で標識した抗体断片の機能を確かめることでした。その抗体断片を、プロテインエクスプレス社が蛍光測定し、両者の結果を突き合わせます。すると、プロテインエクスプレス社で抗体断片に抗原を加えるとなぜか蛍光が強まり、その強さを測るだけで抗原を測定できてしまいました。なぜ蛍光が強まるのか、逆に考えれば、抗原を加える前にはなぜ蛍光が弱まっていたのか。原因を突き詰めていった結果、抗体内に含まれるトリプトファンによる色素消光だと判明したのです」

実験結果を元にした学生とのディスカッションを上田教授は重視している。
使われたのは人工的な抗体断片(一本鎖 Fv、scFv )だが、これを本来の抗体と同じ構造のものに変えてみると、蛍光の応答感度が10倍ほど高まった。さらに当初使った蛍光色素は1色だったところ、色素を2つに増やすと応答感度は50倍に高まった。
「これらはまさにブレイクスルーといえる成果でした。とはいえ実際に自分で手を動かして実験していたわけではないので、結果を聞いた瞬間には驚きつつも、反面では他の可能性も検証する必要があると、自分に言い聞かせていました。そこで当初の興奮が冷めたあとで、考えうる反証を一つずつ潰していったのです。最終的にはトリプトファンを他のアミノ酸に変えて実験すると、明らかに応答感度が下がりました。これにより、トリプトファンによる消光作用だと確信できたのです」
上田教授らが開発した Q-body は、さらに進化を遂げている。その一つが天然抗体の Q-body 化である。これまで抗体は、遺伝子組み換えによってつくられていた。これに対してすでにヒト抗体のライブラリに揃えられている天然抗体を化学修飾して Q-body 化できれば、より速く、しかも簡易に新たな Q-body を開発できる。天然抗体の Q-body 化に関しては、光を活用する光クロスリンク法をすでに開発済みだ。
ラクダ科動物由来の抗体を使った Mini Q-body も開発された。これは通常の抗体と比べて、より安定している小さな重鎖抗体を利用し、抗がん剤や免疫抑制剤として使われるメトトレキサートの血中濃度を検出できる。
次に上田教授らが開発したのは、市販品を含む未修飾の抗体が Q-body 化に適しているかどうかを判定する方法である。
「Q-body は便利ですが、つくるのに時間のかかる点が課題でした。そこでマイコプラズマから発見された抗体結合タンパク質を使って Q-probe(クエンチ・プローブ)をつくりました。これを使えば、特定の抗体について Q-body として使える素質があるかどうかを判定できます」
最新の研究テーマは、“パトロール酵母”の開発だ。これは、酵母を免疫センサーとして活用する新たな食品検査法である。酵母は安全かつ頑丈、増やすのも簡単で、動物細胞と比べてはるかに扱いやすい。しかし、安全で便利なモデル生物であるにも関わらず、これまで生きた酵母を免疫センサーとして活用した研究報告はない。その理由は、酵母が強固な細胞壁に守られているためだ。この細胞壁が障壁となり、細胞膜に抗体を提示しても高分子の検出は不可能と考えられてきた。
「この壁を世界で初めて打ち破りました。まだ研究成果をまとめている段階ですが、細胞壁のまさに“壁”を打ち破ったのです。完成すればパトロール酵母として活用できる可能性があります」
幼い頃を振り返ると、上田教授は電子工作が好きな子どもだったという。生物も面白いとは思っていたものの、特に生物の研究者になろうとは考えていなかった。大学では工学部に進み、一時は電子工学専攻も考えた。
「けれども、すでに LSI やパソコンもでき始めていた時代です。もっと新しいところで、未知のテーマにチャレンジしたい。そう考えて化学工学にひかれたのです。ところが配属された段階で、研究室のテーマが生物に変わってしまいました。そこで先生から抗体でセンサーをつくってみてはと勧められたのが、今の研究に進むそもそものきっかけです」
センサーづくりでは、分かりやすい信号・目印が必要になる。そのため発光生物から発光酵素へと関心領域を深めていき、その過程で蛍の光にも関心を持つようになった。まさに「蛍光」の世界である。
もう一つ、上田教授を常に突き動かしているモチベーションが「今までになかったものをつくりたい」との強い思いだ。その成果が、抗体検出の革新的なツール Q-body 開発につながり、今また“パトロール酵母”で体現されようとしている。

常に疑問を持ち、自分で考える。ブレイクスルーは熟考の積み重ねの中から生まれる。
Q-body の開発は、いくつものブレイクスルーを経て完成に到っている。なぜ、何度もブレイクスルーできたのか。その秘密を尋ねると「試行錯誤しかありません。それも他分野の方々と共同で何かやってみる。いろいろな人との出会いが、ブレイクスルーにつながってきたのでしょう」と、こともなげに語る。
大切なのは、まず手を動かしてみる姿勢であり、結果を見て考える習慣である。
「学生は、思った通りの結果が出ないと、すぐに諦めてしまいがちです。けれども、失敗と思った結果のなかに、実は成功の原石が潜んでいることもよくあります。実際それを見つけるのが、研究の醍醐味かもしれません」
予想もしていなかった結果が出た。そんなときこそチャンスなのだ。
「『それ、本当?』と問い直してみるのです。そこには自分の考えが至らなかった何かが潜んでいたり、未知のものが転がっていたりします」
仮説を立てて実験を行い、考えていたのとは異なる結果が出てきた。そこで単に“うまくいかなかった”で話を終わらせない。そもそも仮説が間違っていたのか、実験によりまったく新しい何かが加わったのか。考えを広げて、何度でも検証を繰り返す。とはいえ、これこそは言うは易く行うは難しの典型ではないのだろうか。
「考えるのはタダですからね」が、上田教授の答えだった。


分子科学に関わる化学と生命科学の領域を包括的にとらえ、新たな性質の解明と技術創出を目的とする。歴史は古く、1939年に開設された資源化学研究所を起点とする。2016年の改組により、科学技術創成研究院 化学生命科学研究所となった。「分子を基盤とする化学および生命化学に関する基礎から応用までの研究の深化、発展を通じて、新しい学理の創成と次世代科学技術の創出を実現し、人類の高度な文明の進化と、より豊かで持続的な社会の具現化に貢献する」をミッションに、分子創成化学、分子組織化学、分子機能化学、分子生命化学の4つの領域で、化学を基盤として物質、資源、エネルギー、医療、生命科学などに関わる研究を行っている。
【取材・文:竹林篤実 撮影:カケマコト】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png