

結核は、人類が克服した「過去の病気」ではない。今日でも世界人口の約3分の1が感染し、毎年200万人もの人が命を落とすとされる、人類にとって現在進行形の脅威だ。日本も、その例外ではないどころか、先進諸国と比べて罹患率の高さが指摘されている。
九州大学生体防御医学研究所の山崎晶教授は、私たちの体が結核菌を認識・排除するメカニズムの一端を、次々と明らかにしている。その成果は、効果的な予防法や治療薬を開発する大きな手がかりとなりうる。山崎教授に、研究の最前線について伺った。

取材中、ラボで学生に気軽に話しかける山崎教授。なかには、フランスからの留学生の姿も(中)。研究室を運営するモットーは、「年齢もバックグラウンドも問わず、一人ひとりの学生をサイエンティストとして尊重し、フェアな議論をすること」。その言葉どおり、学生とのオープンな関係が築かれていることが見て取れる。学生の疑問にも、フラットに耳を傾ける(下)。
結核は、HIV/AIDS、マラリアと並ぶ「三大感染症」のひとつだ。1993(平成5)年には、世界保健機関(WHO)が「結核非常事態宣言」を発表した。日本の罹患率は、先進諸国のなかで突出して高い。人口10万人あたりの感染者数は16.1人と米国の3.1人の5倍以上、ドイツの4.9人の3倍以上だ(出典:平成25年度厚生労働省調査)。1999年には「結核非常事態宣言」が発表された。
我が国では、結核を予防する手段として「BCGワクチン」の接種が励行され、さまざまな薬が臨床現場で使われているが、それでも結核の蔓延を防ぎきれてはいない。
その理由について、九州大学生体防御医学研究所の山崎教授は次のように説明する。
「BCGワクチンは、乳幼児への効果の高さは明らかですが、成人に対してはそれほど有効ではありません。また、薬の効かない『多剤耐性結核』も問題になっており、新たな治療薬が求められるようになっています」
「ワクチン」とは、細菌やウイルスなどの病原体の毒性を弱めたり、病原体を殺して毒性をなくしたりしたものだ。「ワクチン」が感染症の予防につながるのは、私たちの体の中で作用する「免疫」の働きによる。
「免疫」とは、体内に入り込んだ病原体を異物として認識し、それを排除する働きのことをいう。なかでも、一度体内に侵入した病原体を免疫細胞が記憶し、二度目以降の侵入に素早く備える働きは「獲得免疫」と呼ばれ、脊椎動物だけに見られる高度な免疫システムだ。
「ワクチン」が有効なのは、この「獲得免疫」の仕組みを利用しているからだ。
「BCGワクチン」の場合、毒性を弱めた結核菌(弱毒株)を体内に投与し、免疫細胞に結核菌の特徴を覚えさせ、それ以降の菌の侵入に備える。弱毒とはいえ菌であることには変わらず、ワクチン接種によって、なかには感染してしまう人がいることも「BCGワクチン」の短所のひとつだ。
結核の感染を防ぐ、より安全で、成人にも有効なワクチン――。多くの研究者が、その開発に取り組んでいるが、突破口は切り開かれていない。山崎教授は、その難しさを次のように指摘する。
「私たちの体がどのように結核菌を認識して撃退しているか、分子レベルの詳細なメカニズムは解明されていません。つまり、BCGワクチンがなぜ予防に一定の効果を示すのかも、詳しいところはまだよく分かっていないのです。生体内のメカニズムを明らかにすることが、新たなワクチンや治療薬を開発するうえで重要な手がかりになるはずです」
山崎教授の研究チームは、そのメカニズムの一端を解明しつつあり、結核治療の可能性が広がることに期待が寄せられている。
なお、アメーバや昆虫にも、自身の体を守る「免疫」の仕組みは存在する。「自然免疫」と呼ばれるその仕組みは、「獲得免疫」と比べるとメカニズムは単純だ。
「獲得免疫」は、一度侵入を許した病原体に対し、二度目以降は抵抗性を〈後天的に〉獲得する仕組みであるのに対し、「自然免疫」は、生体に〈先天的に〉備わっている免疫応答機能だ。病原体に共通する大まかな特徴を見つけると、免疫細胞が素早く活性化し、病原体を〈食べて〉殺す特徴がある。「獲得免疫」では、免疫細胞が〈武器〉を使って病原体を殺すのと対照的だ。傷口にできる膿(うみ)は、病原体を食べた免疫細胞が、役割を終えて死んだ後の姿だ。
仕組みが単純な分だけ、反応が早いのも「自然免疫」の特徴だ。より高度な「獲得免疫」を持つ脊椎動物も「自然免疫」の仕組みを備えており、まず「自然免疫」で外敵の侵入を阻み、それでも防ぎきれなかった病原体を撃退するために、「獲得免疫」が発動される。
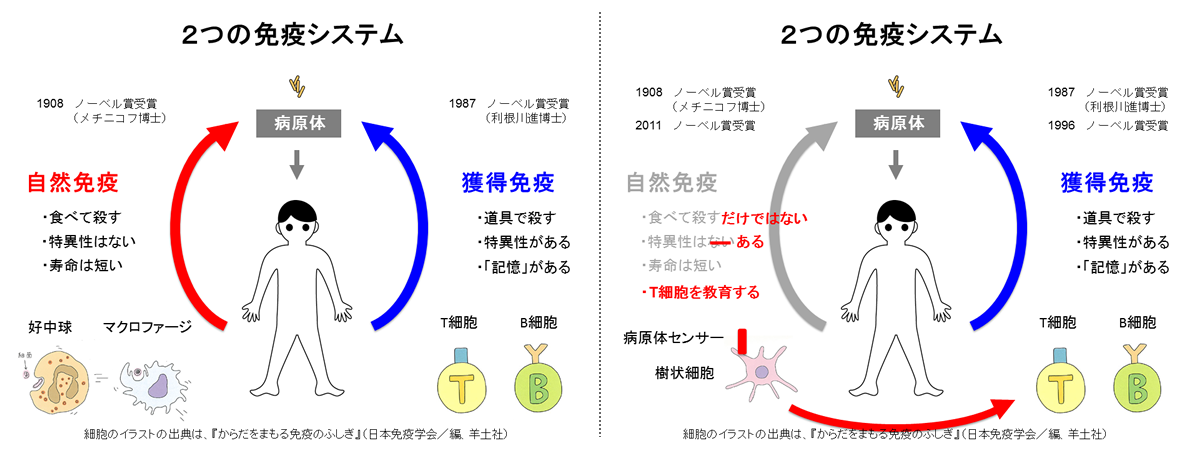
「自然免疫」と「獲得免疫」の特徴の比較。「自然免疫」を司る免疫細胞には、「好中球」と「マクロファージ」、「樹状細胞」などがあり、「獲得免疫」を担う免疫細胞には、「T細胞」と「B細胞」がある。免疫システムの解明は、まず「自然免疫」から進み、1908年にロシアのメチニコフ博士がノーベル医学生理学賞(以下、ノーベル賞)を受賞した。20世紀後半には「獲得免疫」の研究が大きく進展し、1987年に利根川進博士、1996年にも2人の研究者にノーベル賞が授与された。それが最近になって、再び「自然免疫」が大きな注目を集め始めている。「自然免疫」の知られざる仕組みを解明した研究者3名にノーベル賞が授与され、その流れに拍車をかけた。そのときは惜しくも受賞を逃したが、大阪大学微生物病研究所の審良(あきら)静男教授の功績も広く知られる。(図版は山崎教授提供。以下同じ)
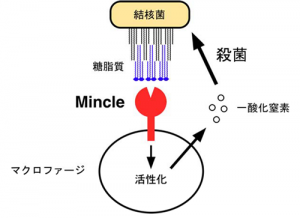
「マクロファージ」が結核菌を認識し、排除しようとする仕組み。「レクチン受容体」の「ミンクル(Mincle)」が、結核菌が持つ糖脂質「トレハロースジミコール酸(TDM)」を認識し、一酸化窒素を排出して菌を殺す。
山崎教授の研究チームは、ここ6年ほどのあいだに、結核菌を認識・撃退するメカニズムを次々と明らかにしている。
生体内で結核菌を認識するのは、「レクチン受容体」と呼ばれるタンパク質でできた構造部だ。「レクチン受容体」は、主に、「マクロファージ」と呼ばれる「自然免疫」を担う免疫細胞に備わっている。山崎教授らは、これまでに3つの「レクチン受容体」が結核菌を認識する仕組みを解明、その成果を発表してきた。
2009年、最初に明らかにしたのは、「ミンクル」と呼ばれる受容体の働きだ。
「ミンクル」は、結核菌が細胞表面に特徴的に持つ「トレハロースジミコール酸(TDM)」と呼ばれる糖脂質を認識する。それによって「マクロファージ」の働きを活性化させ、結核菌を殺す物質を排出する。病原体を食べて殺す「マクロファージ」が、病原体を食べるだけでなく、武器を使ってもいることを明らかにした。
2013年、続いて解明したのが、「MCL」と呼ばれる受容体の働きだ。「MCL」は「ミンクル」に構造がよく似ており、「ミンクル」同様、結核菌の「TDM」(糖脂質)を認識するだけでなく、その後の免疫反応においても重要な働きをしていることを突き止めた。
「MCLは、ミンクルよりも先にTDMを認識し、ミンクルを活性化させる引き金になっていることを発見しました。この2つの受容体は、連携して結核菌の侵入を感知しているのです。さらに、MCLは、獲得免疫を司る『T細胞』の働きを活性化することも明らかにしました。TDMは、以前から免疫活性を高めることが知られていましたが、それは、MCLが『T細胞』を活性化する作用によるものと考えられます。MCLを持たないマウスでは、結核菌への免疫応答が弱くなることが、この見解の裏付けになります」
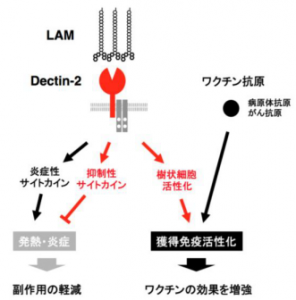
糖脂質の「リボアラビノマンナン(LAM)」を認識した「デクチン(Dectin)-2」が、その後の免疫応答にもたらす影響。「樹状細胞」を活性化し、「獲得免疫」を促進する一方で、発熱・炎症などの免疫反応を抑制するサイトカインを放出する。アクセルとブレーキを同時に踏み、免疫反応の進行を調整していると考えられる。
2014年には、MCLやミンクルとは特徴の異なるレクチン受容体、「デクチン(Dectin)-2」の働きを明らかにした。
「デクチン-2」が認識するのは、やはり結核菌に多く含まれる「リボアラビノマンナン(LAM)」と呼ばれる糖脂質だ。「LAM」を認識した「デクチン-2」は、獲得免疫を促進する「樹状細胞」を活性化させる。すなわち、「デクチン-2」の働きにより、その後の免疫応答が強まるというわけだ。
さらに、この「デクチン-2」には、これまでの2つの受容体には見られない働きがあることも発見した。
「面白いことに、デクチン-2は、LAMを認識すると、免疫応答を抑制する物質もつくり出します。免疫応答を活性化する一方で抑制もするということは、アクセルとブレーキを同時に踏んでいるようなものです。なぜこのようなことになっているか。それはおそらく、過剰な免疫応答を防ぐためではないかと考えられます」
免疫は、病原体の侵入・繁殖を食い止めるために欠かせない仕組みだが、それが働き過ぎと、別の問題を引き起こしかねない。免疫応答の結果として生ずるのが炎症や発熱の症状だが、過剰な免疫応答によって炎症や発熱が悪化し過ぎると、生体そのものを傷つけてしまう可能性があるのだ。
「免疫システムには、応答の強弱を調節する働きがあることが知られており、デクチン-2は、そのための調節弁として機能していると考えられます。デクチン-2の働きを調整することができれば、副作用の少ない新たなワクチンや薬剤の開発につながる道筋が見えてきます」

黙々と実験材料に向き合う研究スタッフ(左)。山崎教授みずから、実験機材を扱って見せてくれた(右)。
実は、山崎教授らが次々と発見した結核菌の受容体には、もうひとつの興味深い特徴がある。それらを形づくる遺伝子は、同じ染色体上に隣り合うようにして並んでおり、DNAの配列まで似通っている。
これらの遺伝子からつくられる免疫細胞の部品には、機能が明らかにされていない受容体と思しきものが多数存在する。山崎教授の研究チームは、それがおそらく、まるごと結核菌の受容体ではないかと当たりをつけた。そしていま、新たに2つの「受容体らしきもの」をほぼ突き止め、それを確認するための研究に取り組んでいる。
ひとつは免疫応答を活性化する働きがあり、もうひとつは免疫応答を抑制する働きがある。こうした複数の受容体の働きを解明することで、巧妙に姿を変える結核菌から、生体が身を守ろうとする仕組みの全容が少しずつ明らかになる。それは新たなワクチンや薬剤の開発につながる大きな一歩となるはずだ。

実験室にはさまざま機材が並ぶ。(左)5年ほど前、従来のものと比べて大幅に小型化された細胞分離機を、日本でいちはやく導入した。(右)薄層クロマトグラフィーの展開槽が林立する実験台。地道な生化学的アプローチが数々の発見の基礎となった。
なぜ、結核菌を認識するのに、いくつもの受容体が存在するのか。そこには、ヒトと病原体との闘争の歴史が垣間見える。
「ヒトをはじめとする動物は、細菌やウイルスなどの病原体から身を守るため、免疫機能を発達させてきました。対する病原体は、免疫システムから逃れて生き延びるため、巧妙に姿を変えます。いわば、結核菌というひとつの病原体が、いくつもの“顔”を持っているわけです。ヒトもそれに対抗するため、結核菌を認識するいくつもの受容体を備えてきたと考えられます。ただ、いまだに多くの人類が結核菌に感染していることを考えると、人類と結核菌との戦いは、結核菌に軍配が上がるのかもしれません」
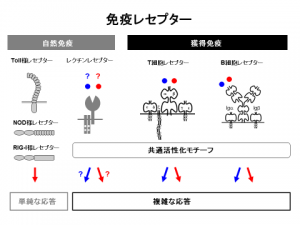
自然免疫と獲得免疫の中間的な特徴を持つ「レクチン受容体」。自然免疫よりも複雑な応答を、獲得免疫よりも素早く活性化させることができる。なお、自然免疫の3種の受容体(レセプター)、「Toll様受容体」、「NOD様受容体」、「RIG-I様受容体」を明らかにした研究者は、2011年にノーベル賞を受賞した。
山崎教授は続けて、免疫システムにおける「レクチン受容体」の意義について触れる。
「レクチン受容体は、自然免疫と獲得免疫の中間的な特徴を備えています。単純でも素早く応答する自然免疫は、病原体に対する第一の防波堤として働きます。対する獲得免疫は、高度で複雑な反応を示しますが、活性化するのに時間がかかります。レクチン受容体は、獲得免疫よりも素早く、自然免疫よりも複雑な応答を示します。ひょっとすると、両者のタイムラグを埋めるため、進化の過程で発達してきたのかもしれません」
山崎教授はさらに、レクチン受容体の機能的な特徴も指摘する。
「獲得免疫を担う『T細胞受容体』と『B細胞受容体』、それに、これまで知られていた自然免疫受容体は、脂質を認識するのが比較的苦手です。TDMやLAMのような糖脂質を認識できるレクチン受容体は、機能面でも、2つの免疫応答の穴を埋める役割を果たしているのではないかと考えています」
結核菌受容体の働きを次々と明らかにする山崎教授だが、この分野の研究に取り組み始めたのは、ほんの偶然なのだという。
「もともと目指していたのは、獲得免疫を担うT細胞が、多様な病原体を見極める仕組みを明らかにすることです。T細胞は、100兆種類もの受容体を持ち、種類ごとに異なる免疫応答を示すとされています」
それだけの種類があっても、通常T細胞は自分の細胞を攻撃してしまうことはない。T細胞がどのようにして病原体の違いを見分け、異なる細胞応答を示すのか……。その普遍原理を知りたいと研究に取り組んでいたが、多様なT細胞受容体を相手に原理を一般化することは難しかった。もう少し単純化したモデルで考えるべく、研究の糸口を探していたら、その候補としてミンクルに辿り着いた。
「ミンクルについて調べてみると、私の仮説は見事に外れていたのですが、面白い動きをすると感じました。興味を持ってさらに調べてみたら、結核菌の受容体であることが分かり、しかもその周辺にDNA配列がそっくりの受容体らしきものが存在していました。それらの機能をひとつずつ明らかにするのが、当面の目標です」

穏やかな表情と口調で研究を語るその内面で、サイエンスへの情熱が尽きることなく溢れているのを確かに感じた。
免疫システムは、いかにして自己と非自己を見極めているのか――。
その壮大な問いを、山崎教授は今も変わらず持ち続けている。
「この問いの設定が正しいのかどうか、自分でも分かりません。それでも、その問いに応えるべく一歩一歩進んでいたら、途中でものすごく面白い世界に巡りあった。今はそういう心持ちです。これからも弛まず歩み続ければ、これまで見たことのない世界を見ることができるかもしれない。その信念が、研究を支える原動力になっています」
山崎教授が、研究で大切にしているのは、自然に対して謙虚な姿勢を持ち続けることだ。
「自然はとても人智が及ぶものではなくて、人間がない知恵を必死に絞って、その一端がかろうじて見えるかどうかです。研究では、仮説を立ててそれを実証するために実験に取り組みますが、仮説が当たることはきわめて稀で、たまにかすればいい方です。そのかすって見えてきたことから、あらためて自然を見つめなおすと、自然は実にうまくできていると、畏敬の念が大きくなります。自然科学のなかでも私が生命科学に惹かれるのは、進化について考察することができるからです。一見すると不合理な働きでも、それが今も機能しているということは、生存のうえで何らかの利点があることを示唆します。それを少しでも解き明かしていけるのが、生命科学の醍醐味です」
結核菌との戦いに挑む山崎教授は、自然に対して畏敬の念を持ち続け、生命科学を心から愛する研究者であった。


http://www.bioreg.kyushu-u.ac.jp/
1982(昭和57)年、九州大学温泉治療学研究所(大分県別府市)と医学部附属癌研究施設(病院地区)の統合により本研究所が発足。温泉治療学研究所は1931(昭和6)年に、医学部附属癌研究施設は1955(昭和30)年に、それぞれ前身となる組織が開設された。
生体の恒常性を維持するために重要な「生体防御」をテーマに据え、生命現象の本質に迫る基礎研究を展開する。あわせて、生体防御機構の破綻がもたらす疾患の発生機序を解明し、診断・治療法を確立するための研究にも取り組む。この分野で国内屈指の実績を誇り、国際的にも高い評価を受ける。
2015年11月現在の組織は、「ゲノム機能制御学部門」、「細胞機能制御学部門」、「個体機能制御学部門」の3部門(8分野)と、「トランスオミクス医学研究センター」、「生体多階層システム研究センター」、「感染ネットワーク研究センター」の3附属研究センター(14分野)からなる。生体防御システムを多角的に解明すべく、理医連携のコアとして、研究と教育に取り組む。
(建物外観の写真は、九州大学生体防御医学研究所の提供)
【取材・文:萱原正嗣/撮影:山本薫】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png