

生命科学の発展で、ゲノムの解析や遺伝子の改変も可能になった。だが、遺伝子から作り出された無数のタンパク質が、生物の体の中でどのように働いているのかについては、多くの謎が残されている。岡山大学異分野基礎科学研究所の菅倫寛准教授は、タンパク質の立体構造を研究する「構造生物学」の手法で、生命の謎を解き明かそうとしている。
タンパク質は、生物が生命活動を行うのに欠かせない部品だ。体を構成する材料になるだけでなく、生物という精密機械を動かすためのさまざまな機能を担っている。タンパク質の働きを知ることができれば、生命の仕組みの解明に近づくことができるだけでなく、薬や人工光合成のような画期的な技術の開発にもつながることが期待できる。
しかし、ほとんどのタンパク質の大きさはせいぜい1~10 nmで、ウイルスよりも小さい。体のどこに存在するかを調べることができても、生体内の反応の様子をつぶさに観察することは困難だ。

自然の真の姿を、構造から明らかにしたいと語る菅准教授。
菅准教授が専門とする構造生物学は、生体分子の立体的な構造を明らかにすることで、その働きを理解しようとする研究分野だ。具体的には、生体内にあるタンパク質を取り出して結晶化しX線を用いたり、クライオ電子顕微鏡を用いたりして、その立体構造を解析する。
「生物の体の中では、通常の条件では起こりにくい化学反応が、触媒となるタンパク質のおかげで効率よく進んでいきます。触媒は反応を進ませるときに、わずかに構造を変化させるので、触媒の詳細な構造を解明すれば、反応の様子も予測できます」
さらに、原子同士の正確な距離と電子の数がわかれば、原子構造を決定でき、そこから原子の間に働くエネルギーを計算して起こり得る化学反応の候補を絞ることができるという。
「ほかにも、さまざまなことが分かります。光合成のときに太陽光エネルギーを集める役割をもつ集光色素を持つタンパク質がありますが、それらの位置や向きが解明されると、エネルギーが流れていく経路や速度の予測も可能です」
菅准教授は、さまざまな生物のタンパク質の構造解析を行う。そのなかでも、同研究所の沈建仁教授とともに進めている光化学系Ⅱ(PSⅡ)の解析は、世界的な成果を挙げ、今もトップを走り続けている。
PSⅡは、光合成反応のうち、水から酸素を作る反応を起こすために欠かせない巨大なタンパク質複合体だ。PSⅡの働きを知ることは、地球上の生物の進化を考えるうえで非常に重要な意味をもつ。約30億年前、光のエネルギーと水から酸素を作り出すシアノバクテリアが誕生したおかげで、現在の地球の生態系が作られたからだ。
シアノバクテリアが誕生する前は、大気中に酸素はほとんど存在しなかった。シアノバクテリアの作り出す酸素が長い年月をかけて大気中に蓄積し、酸素を利用する生物の進化を助けた。また、酸素の一部はオゾン層を形成し、地球に降り注ぐ有害な紫外線が吸収された。それにより、生物が海から陸へ進出できたことを考えても、PSⅡの仕組みの解明は、生命の起源に迫る重要な研究である。
さらに、PSⅡの研究で得られた成果は、光と水から有用な物質を作り出す「人工光合成」の実用化の強力な後押しになり得る。
「水から電子を取り出して酸素を作るというのは、非常に起こりにくい反応です。長い地球の歴史のなかで、生物がたった1回しか成功していない現象です。レアメタルのような特殊な金属を使わずに、身近な金属であるマンガンやカルシウムを使って反応を行っていることや、反応の途中で生じる活性酸素に分子を破壊されることなく、繰り返し反応サイクルを回すことができている点も驚きです。PSⅡがどうやってこれらの化学反応を成し遂げているのか、世界中の研究者が強い関心をもって調べています」

研究室では、PSⅡを抽出するために、和歌山県の湯の峰温泉に生息するシアノバクテリアを培養している。温泉に住むバクテリアはタンパク質が高い温度でも壊れにくいため、実験しやすい。

学生や研究員たちが熱心にディスカッションを行う菅研究室は、若々しい活気に満ちていた。
激しい競争が繰り広げられるなか、世界で初めてPSⅡの触媒部位の立体構造を明らかにしたのが、沈教授のチームだった。この成果は2011年に、Nature誌に発表され、さらに同年のScience誌の「科学10大成果」にも選ばれた。
「PSⅡによる水分解の仕組みは長い間謎に包まれていましたが、沈教授のチームは、当時の世界最高の解像度で構造解析を成功させました。成功の秘訣は、2009年に良質な結晶を得られたことにありました。生体分子の構造解析は、どれだけ高品質な結晶を作ることができるかで、実験の精度が大きく変わってくるのです」
これまでの解析では、マンガン原子の位置は分かっても、酸素原子までは分からなかった。だが沈教授らは、5つの酸素原子の位置も特定し、PSⅡの触媒部位が歪んだ椅子のような構造をしていることを初めて明らかにした。
2012年から沈教授のチームに加わった菅准教授は、2011年の解析の精度をさらに高めることを試みた。ちょうど、世界最先端の「X線自由電子レーザー施設SACLA」が完成し、供用を開始した年だった。
「2011年に発表したPSⅡは、強力なX線を当てて解析を行っているため、X線によって損傷を受けた状態を見ている可能性がありました。SACLAは波長の短い強力なX線レーザーを、十数フェムト秒(フェムト秒は100兆分の1秒)のうちに測定試料に打ち込むことができる施設です。SACLAを利用してもPSⅡの結晶は損傷しますが、フェムト秒のパルスなら、壊れる前にデータを収集することができます」

PSⅡを結晶化する作業。サンプルにダメージを与えないように、PSⅡが吸収しにくい弱い緑の光だけを使って行う。
2011年の解析のときは良質な結晶が1つあればよかったが、計測するごとに壊しながら解析していくこの方法は、数百個単位で高品質な結晶が必要だった。シアノバクテリアを大量に培養してPSⅡを抽出しては結晶化する地道な作業を繰り返し、SACLAに何度も通って測定した。チーム一丸となって進めたおかげで、2015年にはSACLAの解析で得られた結果をNature誌に発表することができた。
「SACLAで解析を行った結果、2011年の結果よりもマンガン原子間の距離が0.1~0.2Å(1Å=1000億分の1m)短いことが判明しました。たった0.1Åですが、全体的にどの距離も同じように短くなっているので、これは誤差ではありません。2011年の結果はX線による損傷を受けていたことが分かったのです」
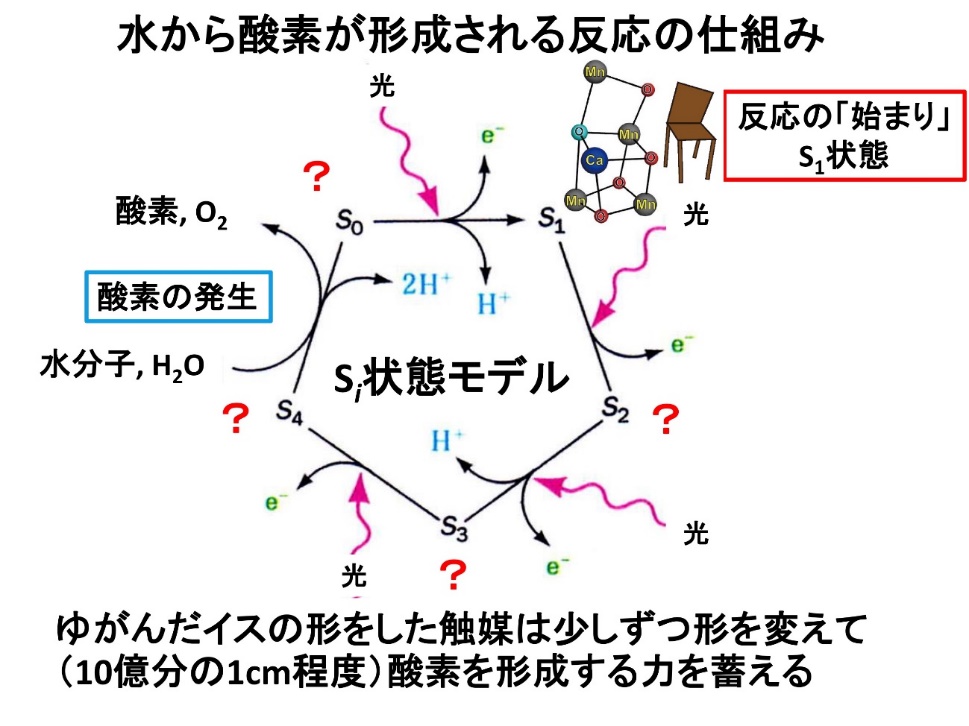
PSⅡで水から酸素が形成される反応の仕組み。PSⅡは、光を吸収するたびに触媒部分の酸化状態が変化して少しずつ形を変えながら酸素を形成する力を蓄える。暗所で安定に存在するS1状態から3度光を吸収してS4状態に到達すると、酸素が発生してS0状態にもどる。
一方、SACLAで解析してもPSⅡが「歪んだ椅子」構造であることには変わりなかった。O5と名付けられた酸素原子だけが、周囲の原子との結合距離が長い。ここだけ他の酸素原子と結合の様子が違うことから、菅准教授は、O5で水分解反応が行われているのではないかと考えた。
だが、それを証明するためには、反応の始まり(S1)だけでなく、反応の途中段階(S2~S4)を解析する必要があった。
「反応の途中段階を解析するには、PSⅡ結晶に光を当てて、反応を進ませながら測定する必要があります。しかし、2015年に用いた結晶は大きすぎて光が届きにくく、上手くいきませんでした。そこで、結晶を小さくして試みたのですが、そうすると今度は結晶が不安定になって計測前に壊れてしまいます。ちょうどよい条件を研究室のメンバーと一緒に試行錯誤して、最終的には何とか解析することができました」
中間状態のS3を解析すると、PSⅡの形がわずかに変化して、O5の周りに空間ができ、O5の近くに6個目の酸素原子O6が存在することが判明した。
「これらの結果を踏まえ、私たちはO5から酸素分子が形成されるモデルを提案しました。PSⅡの構造が変化して空いたスペースに水分子が入って酸素原子O6を供給し、その後、O5とO6が結合して酸素分子O2が発生するというモデルです。2017年にNature誌で発表しました」
ただし、この成果は、O6の存在を証明したものの、その後の反応経路を示す決定打にはならなかった。菅准教授らは、サンプルの凍結方法を工夫することで、解像度を2.35Åから2.15Åに改善し、理論計算を併用することで、さらに詳細な解析を成功させた。その研究結果を2019年にScience誌に発表し、2017年に提案した仮説の正しさを自らの手で証明した。

解析結果をもとに作製したタンパク質の立体構造を見ながら研究メンバーとディスカッションする菅准教授。3Dメガネを装着して立体構造を確認する。
現在、菅准教授はS4状態の解析も進めている。また、光合成のもう1つの重要な反応を担うPSⅠの解析や、イネなどの作物でミネラルを取り込み輸送する機能を担うたんぱく質の解析も行っている。
「今回お話ししたPSⅡの反応は光合成で酸素が形成される反応のプロセスのごく一部です。他にも水分子から抜き取った水素イオンを排出したり、水が触媒の中に入ってくるタイミングを制御したりする必要があり、非常に厳密な制御のうえで全体の反応が成り立っています。そのような生物のもつ精巧な仕組みを理解したくて、研究に取り組んでいます」
菅准教授は、学生のときに配属された研究室が構造生物学だったことから、この世界に足を踏み入れた。そして、当時の指導教官のアドバイスを素直に受けて、研究者の道へ進むことを決めた。
「将来私はどうしたらいいでしょうかと指導教官に相談したところ、『君は海外に行って研究し、日本に帰ってきて研究者を続ければいい』と言われたので、その通りにしました。もっとほかの人にも意見を聞いた方がよかったのかもしれませんが、先生自身が心から楽しんで研究をしていたので、研究者というのは、さぞ面白い仕事なのだろうなと思えたことが大きかったかもしれません」

自分のことを楽観的な性格だと話す菅准教授。
菅准教授の背中を押した指導教官は、世界で初めてほ乳類の膜タンパク質の立体構造を解析した月原冨武教授(大阪大学蛋白質研究所)だ。月原教授に影響を受けた菅准教授は、今では若手研究者に影響を与える側になっている。
「学会で出会った学生さんに、『先生の論文を読んで構造生物学の研究室に入ることを決めました』と言われたことがありました。自分がやってきた仕事が誰かを動かしたというのは、とても嬉しいですね」
そう言って笑う菅准教授も、心から研究を楽しんでいるようだった。


岡山大学が強みを持つ分野である「量子宇宙」「超伝導・機能材料」「光合成・構造生物学」研究を、統一的かつ組織的に遂行するために2016年に設置された研究所。物質の最小単位である素粒子から、生体で働く超分子複合体まで、テラ・スケールの広がりの物質構造解析を行っている。基礎科学の異分野融合により、エネルギー問題の解決や産業技術の革新を目指している。
【取材・文:寒竹泉美 撮影:大島拓也】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png