

地球上の多くの高等生物は、オスとメスという2つの性に分かれている。ほ乳類がオスになるかメスになるかは、生まれたときの性染色体によって決まる――。かつてはそう考えられてきたが、近年の研究により、その見方は塗り替えられつつある。
生物はどのようにして「性」を制御しているのか。徳島大学先端酵素学研究所の立花誠教授は、ほ乳類の性決定の謎に迫る。

研究メンバーとディスカッションする立花教授
ほ乳類の性染色体にはX染色体とY染色体の2種類が存在する。XとYの組み合わせだとオス、XとXの組み合わせだとメス。中学校や高校でそう習った人もいるだろう。
だが最近の研究で、性は性染色体の組み合わせだけでは決まらないことが分かってきた。Y染色体があっても、Y染色体中の「性決定遺伝子」が正しく働かないと、オスにはなれない。
性決定遺伝子の名は「Sry」という。「Sex-determining Region on the Y chromosome(Y染色体における性決定領域)」の略称である(なお、遺伝子の名称は斜体で表記するのが慣例であり、本稿でもそれに従う)。
立花教授は、性決定遺伝子「Sry」を制御する機構を明らかにした。カギを握るのは「Jmjd1a」という名の「酵素」だ。そのことを、立花教授は2013年に発見した。
「Jmjd1aが産生されないよう遺伝子を改変したノックアウトマウスをつくり、Jmjd1aの働きを調べました。通常、マウスはほぼ1:1の割合でオスとメスが生まれてきますが、ノックアウトマウスから生まれた111匹のマウスのうち87匹、実に8割近くがメスの姿をしていました。これはおかしいとマウスを解剖してみると、オスの姿をしているマウスのなかには、オスとメスの両方の生殖器をもつマウスがいました(下写真参照)」
何かが起きていると感じた立花教授はノックアウトマウスの染色体を調べた。染色体の組み合わせは、メスになるはずのXXが53匹、オスになるはずのXYが58匹だった。これだけ見るとほぼ1:1だ。だが、Y染色体を持っているマウスのなかには、卵巣を持って完全にメス化した個体が34匹、卵巣と精巣を両方持つ個体が7匹いた。
なぜこのようなことが起きたのか――。それを調査してみると、Jmjd1aはSryのスイッチをオンにする働きをしていることが分かった。すなわち、Jmjd1aノックアウトマウスではSryが働かず、Sryが働かないと、Y染色体があってもオスにならずにメス化してしまう個体が現れる。精子形成に重要だと考えられていたJmjd1a遺伝子が、性決定にも大きく寄与することが分かったのである。
この実験結果は、「ほ乳類の性は、受精時の染色体の組み合わせによって決定する」という従来の常識を覆した。性は染色体だけでは決まらない。酵素も重要な役割を果たしている。さらに、性は受精時ではなく受精後に決まることを示したのだ。
この研究成果は英国の科学誌『Science』に掲載され、日本の新聞やテレビなどでも「オスをメスにする酵素の発見」として大きく取り上げられた。
研究は大きな成果をもたらしたが、立花教授は最初から性決定のメカニズムを調べようと思っていたわけではない。以前よりJmjd1aは、マウスの精子がつくられるときに多く現れる酵素として知られていた。立花教授がJmjd1aについて調べたのは、Jmjd1aが精子形成にどのように関与するのかを調べるためだった。
「ノックアウトマウスの作製完了まであと一歩というところで、海外の研究グループに先を越されてしまいました。ノックアウトマウスでJmjd1aと精子形成の関係を調べるというまったく同じテーマで、研究成果が発表されてしまったのです。論文を見つけたときは途方に暮れ、これから何をやったらいいのかと思いましたが、生まれてくるマウスの性の異変に気づいたおかげで研究を進めることができました」
立花教授らの大発見は、不運と幸運がきっかけだったのである。

波乱万丈な研究人生だが、立花教授は静かに淡々と語っていく。
だが、ノックアウトマウスで先行した海外の研究グループは、メスが多く生まれる現象にどうして気づかなかったのだろうか。
「彼らが実験に使ったノックアウトマウスの系統は、私たちが使ったノックアウトマウスの系統と比べてJmjd1aの性決定の変化が現れにくいという特徴がありました。私たちが用いた系統では、Y染色体を持ちながらメスの姿になる割合は8割近くになりましたが、彼らが用いた系統では5%以下でした。それだとオスとメスが生まれる割合は通常とほとんど変わりません。見た目は普通のメスですから、特になにもなければわざわざ染色体を調べようとはしないでしょう。私たちはたまたまというか、偶然に助けられました」

組織をパラフィンで固めて、薄くスライスし、標本を作製する。

薄くスライスした組織を蛍光色素で染色すると遺伝子の発現を顕微鏡下で観察できる。

顕微鏡を覗く立花教授。ノックアウトマウスを1つ1つ解析していくのは時間と根気が必要だ。
実は、立花教授が長年追いかけているテーマは「性」ではない。「エピジェネティクス」だ。「エピジェネティクス」とは、「後からの」という意味の接頭語「エピ(epi-)」と、「遺伝学」を意味する「ジェネティクス(genetics)」を組み合わせた語である。
生物の特徴は、すべてが遺伝子によって先天的に決まるわけではない。遺伝子がいつどのように発現するかによっても左右される。エピジェネティクスとは、こうした遺伝子発現制御機構が生物の特徴に与える影響について調べる学問分野である。
生物のDNAは、生まれてから死ぬまで基本的には変わらない。また、ひとつの生物個体のなかでは、どの細胞も同じDNAを持っている。にもかかわらず、体の場所や役割によって細胞が機能や形を変えるのは、遺伝子の発現を制御する機構があるからだ。
性決定遺伝子Sryのスイッチを入れる酵素Jmjd1aも、エピジェネティクスのひとつの例だ。遺伝子のスイッチをオン・オフして、どちらの性になるかを「後から」アレンジするのである。
この分野を選んだきっかけを立花教授に尋ねると、「これまた偶然なんですが……」と20年前のエピソードを語ってくれた。
「昔、製薬会社に勤めていたことがあります。そこでガンに関係する酵素を探していて、G9a/GLP複合体という酵素を見つけました。ところがその酵素はガンとはあまり関係なく、どういう働きをしているのかなかなか分かりませんでした。いろいろ調べていくうちに『ヒストン』に働きかける酵素だと判明しました」
「ヒストン」とは、染色体を構成する主要なタンパク質で、DNAが巻き付く芯のような役割を果たす。それにより細胞内にDNAをコンパクトに収納するだけでなく、DNAの遺伝情報の読み取りを調整する役割も担う。ヒストンに加わる化学的な変化(修飾)は、エピジェネティックな制御の代表的なもののひとつである。
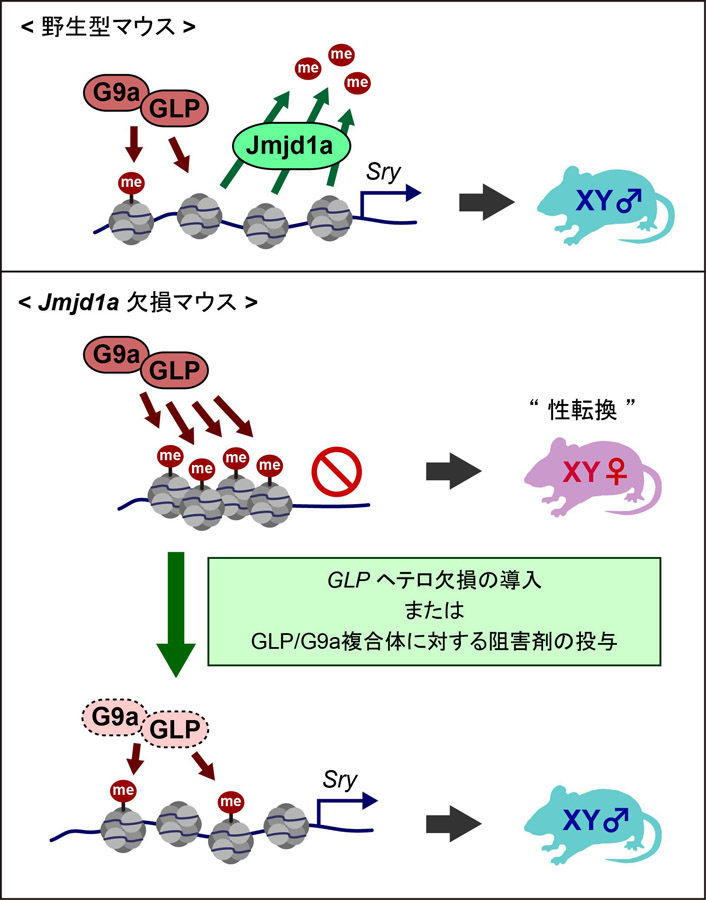
通常のマウス(野生型マウス:上)とJmjd1aをノックアウトしたマウス(欠損マウス:下)での、G9a/GLP複合体とJmjd1a、性決定遺伝子Sryの関係。グレーの部分は染色体中のヒストンを、「me」とあるのはメチル基を示す。通常のマウスでは、G9a/GLP複合体がヒストンをメチル化し、Jmjd1aが脱メチル化してSryが働き始めるが、ノックアウトマウスではJmjd1aがないためSryが働き始めない。ただ、G9a/GLP複合体の働きを弱めると、ヒストンのメチル化がそれほど起こらず、Jmjd1aがなくともSryが働き始める。
G9a/GLP複合体は、立花教授をエピジェネティクスの世界に引き込んだだけではなかった。それから約20年が経ち、G9a/GLP複合体もJmjd1a同様、性決定を調節している酵素であることが分かってきたのだ。
だが、その働き方はJmjd1aと真逆だった。ヒストンを化学的に修飾する主な方法として、「メチル化」と「脱メチル化」がある。「メチル化」とは、DNAやヒストンなどに「メチル基(CH3)」が付加する化学反応のこと、「脱メチル化」は反対にメチル基が外れる反応のことだ。
「Jmjd1aはヒストンを『脱メチル化』する酵素です。ヒストンからメチル基を取り除き、性決定遺伝子Sryのスイッチをオンにしています。対してG9a/GLP複合体はヒストンを『メチル化』する酵素です。メチル化によって性決定遺伝子Sryはスイッチがオフになります」
通常の状態では、G9a/GLP複合体がヒストンをメチル化し、それをさらにJmjd1aが脱メチル化する。それによって、性決定遺伝子Sryのスイッチがオンになり、マウスはオスになる。ところがJmjd1aノックアウトマウスだと、G9a/GLP複合体によってヒストンがメチル化されたままになるためSryは働かず、マウスはオスになれない。
また、G9a/GLP複合体の働きを弱めてメチル化を抑制すると、Jmjd1aがなくてもSryのスイッチがオンになり、マウスはオスになる。このことから、マウスがオスになるかどうかは、メチル化の量がある閾値を越えるかにかかっていると立花教授は考えている。
マウスがオスになるかどうかは、メチル化の多寡にかかっている。しかも、場合によっては、見かけはメスでも乳腺や卵巣を持たない「メスらしくないメス」や、見かけはオスでも精巣が十分に発達していない「オスらしくないオス」も生まれてくる。
その状況をつぶさに観察・考察するうち、立花教授はこう考えるようになった。性はオスかメスかの二項対立で決まるのではない。オスとメスの間に、中間的な性の状態がグラデーションとして存在する。すなわち、性の実態は連続した状態(スペクトラム)なのではないかと……。
この仮説を検証するため、立花教授は目下、新学術領域研究(平成29〜33年度)「性スペクトラム−連続する表現型としての雌雄」という研究プロジェクトを進めている(教授がプロジェクトの代表を務めている)。
このプロジェクトのもっともユニークな点は、オス化の程度やメス化の程度を定量的に把握しようとしていることである。そのなかで立花教授が目指すのは、Jmjd1aやG9a/GLP複合体を活用し、メチル化・脱メチル化を指標として性スペクトラムを定量化することだ。
「酵素は温度や薬剤などの外的要因によって働き方が変わります。性決定が環境によって変わりうるのか、変わるとしたらどのように変化するのかを調べています。ただ、ほ乳類の性決定が、なぜこのようなエピジェネティックな調整を受けているのかはまったくの謎です。いずれはその謎を解き明かしてみたいと思っています」
教授の目は、性決定のメカニズム解明だけではなく、性が生まれた背景を見据えている。
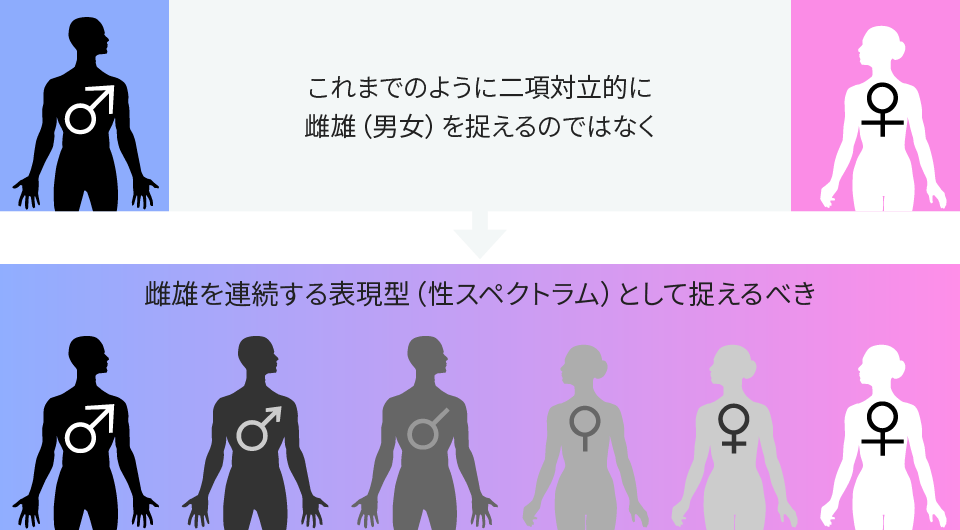
性スペクトラムの概念図。雌雄だけではなく、雌に近い雄、雄に近い雌など、間の性が存在する。(新学術領域研究「性スペクトラム−連続する表現型としての雌雄」のHP http://park.itc.u-tokyo.ac.jp/sexspectrum/ より引用)
近年、「LGBT」という言葉をよく目に耳にするようになった。Lはレズビアン(女性同性愛者)、Gはゲイ(男性同性愛者)、Bはバイセクシュアル(両性愛者)、Tはトランスジェンダー(生物学的な性と自認する性の不一致)である。このように、ヒトに関しては、男と女の2種類の性で簡単に分類できないことはよく知られるようになり、二項対立ではない性の多様性の理解が広がり始めている。
性の実態がスペクトラムであると突き詰められれば、LGBTを巡る社会的な動きは、生物学的な裏付けを得ることになるかもしれない。科学がもたらす新たな知見は、ときに人類の世界の見方を大きく変えてきた。性スペクトラムの研究は、性への理解を一変させる可能性を秘めている。


「疾患酵素学研究センター」「疾患プロテオゲノム研究センター」など4研究所を統合し、2016年に設置された。酵素をはじめとするタンパク質の分子機能の研究を基盤に、ゲノムから個体に至る生命情報を統合的に理解する先端的な基礎医学研究を推進する。健康長寿社会の実現に向けた難治性疾患および慢性疾患、とりわけ免疫難病と糖尿病の根本的理解と治療法の開発を目指している。
【取材・文:寒竹泉美 撮影:楠本涼】
 bana1.png (300px×80px)
bana1.png (300px×80px) bana1_e.png (300px×80px)
bana1_e.png (300px×80px) NovelPrize2015.png
NovelPrize2015.png